题目:A high-resolution 3D epigenomic map reveals insights into the creation of the prostate cancer transcriptome
期刊:nature communications
影响因子:11.878
主要技术:Hi-C、ChIP-seq、RNA-seq、NOMe-seq
研究背景
前列腺癌是主要的新癌症,是男性的第二大常见癌症和全球第四大常见肿瘤类型。与正常前列腺细胞不同,前列腺癌细胞转录极大失调,细胞增殖不受控制。因此,新发现的控制前列腺癌转录组机制将为诊断和治疗提供有价值的信息。
人类基因组在细胞核的三维(3D)空间中分为活跃和不活跃的区室,高接触频率的区域称为拓扑关联域(TAD)。随着细胞从一种类型变为另一种类型,部分TAD会在活跃和不活跃染色质状态之间转换,TAD的状态改变会影响TAD内基因的表达水平,而且基因通常是由位于同一TAD中的增强子调控的。在由CTCF结合的调控元件对之间的染色质环改变,可能会使远距离调控元件的启动子聚集在一起(或分开),从而引起基因表达的变化。因此,转录组可能会受到TAD边界变化的影响。通过原位Hi-C技术,结合ATAC-seq或NOMe-seq(核小体占据和甲基化测序)等方法从中推断出染色质相互作用中涉及的TF,定义了与TF相对应的核小体耗尽区(NDR)。本文研究了a.TAD的表观遗传状态,b.识别并表征正常和癌症特异性的增强子-启动子环。TAD和染色质环的这种特征提供了更详细的前列腺肿瘤发生的表观遗传机制。
研究思路:
研究结果
1、导致转录组变化的癌症特异性TAD
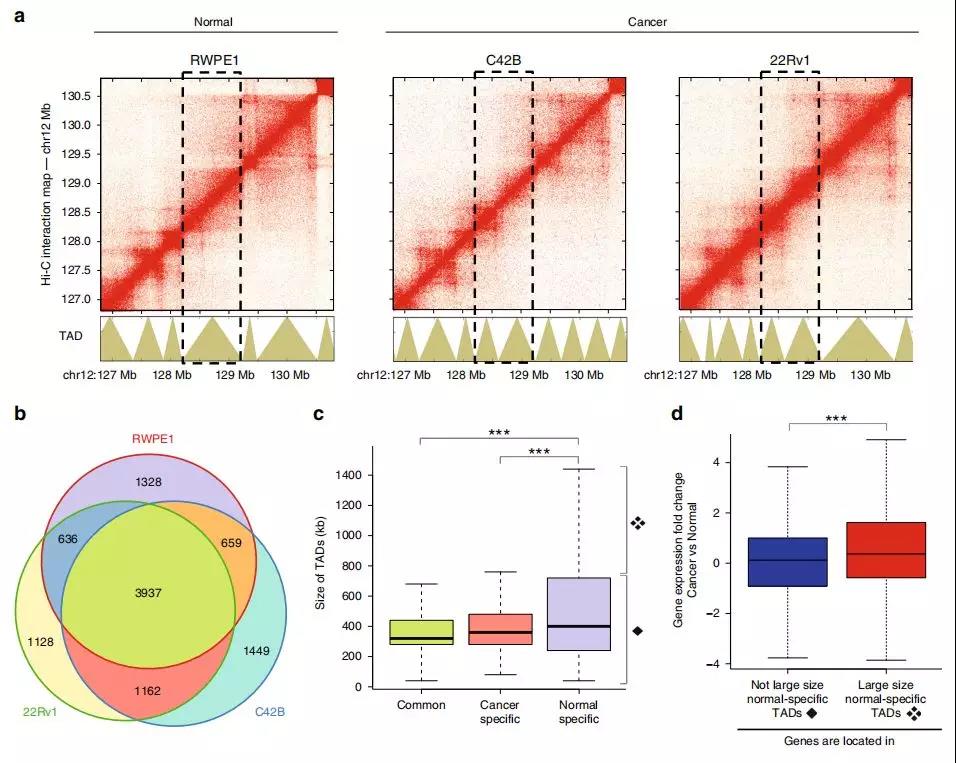
作者在正常前列腺(RWPE1)细胞、前列腺癌(C42B 和 22Rv1)细胞使用原位Hi-C构建了高分辨率的染色质互作数据。在所有三种细胞系中,作者发现3937(〜60%)的TAD具有边界(图1b)。这些常见的TAD的平均大小约为350 kb(图1c)。作者发现1328个TAD在RWPE1细胞中检测到的,但未在任一癌细胞系中检测到;有1162个TAD在两个癌细胞系中有但在正常细胞中均未检测到的。有趣的是,正常细胞的特异性TAD通常大于癌症细胞的特异性TAD。
TAD的大小变化可能与基因表达变化有关,比较正常细胞和癌细胞全基因组之间的TAD大小,在正常细胞中鉴定出约520个大TAD,相当于癌细胞中约850个较小TAD。与正常细胞相比,在这些改变的TAD中,在癌细胞中表达的基因相对更多(图1d)。较小的TAD中的许多基因具有更高的转录活性,这表明较小的TAD会将基因与抑制元件隔离开来。
Fig. 1 TAD边界的改变导致前列腺癌转录组的改变
2、可改变染色质状态的普通TAD
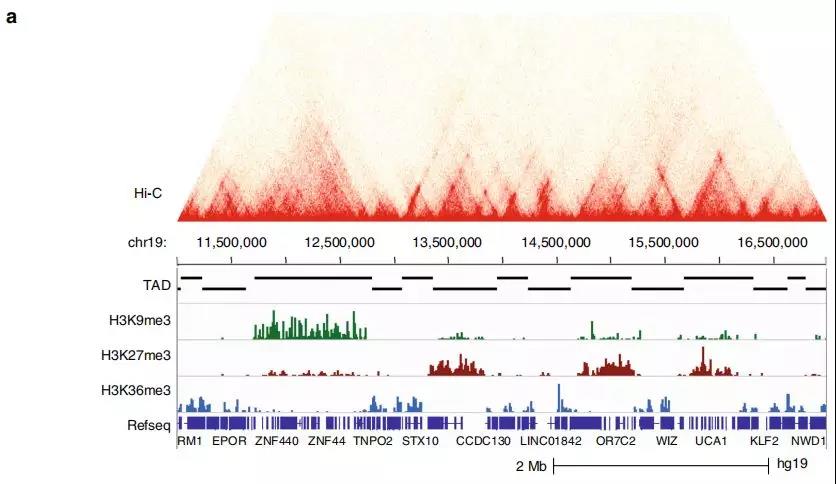
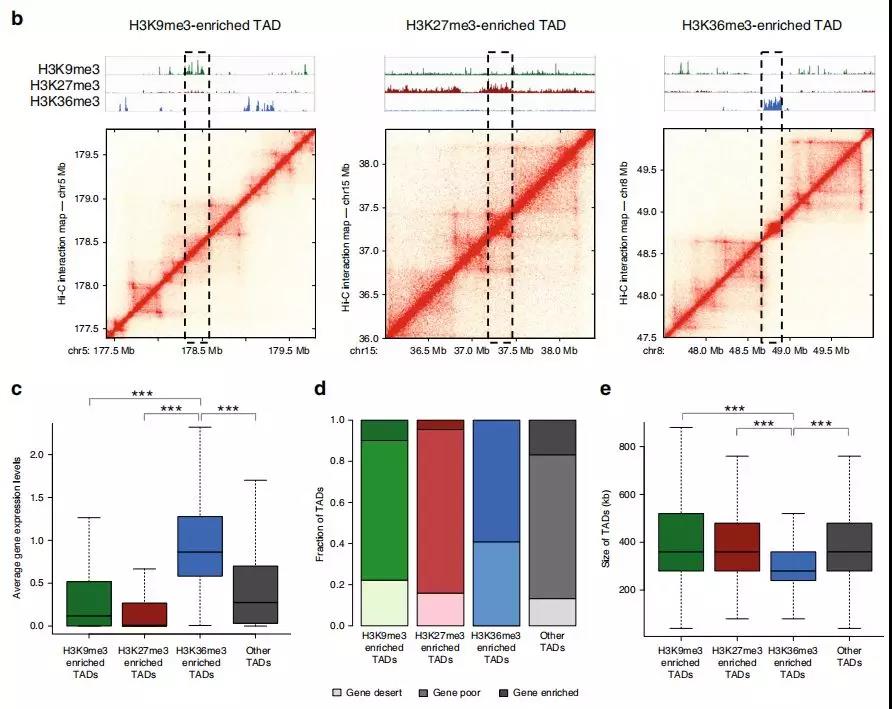
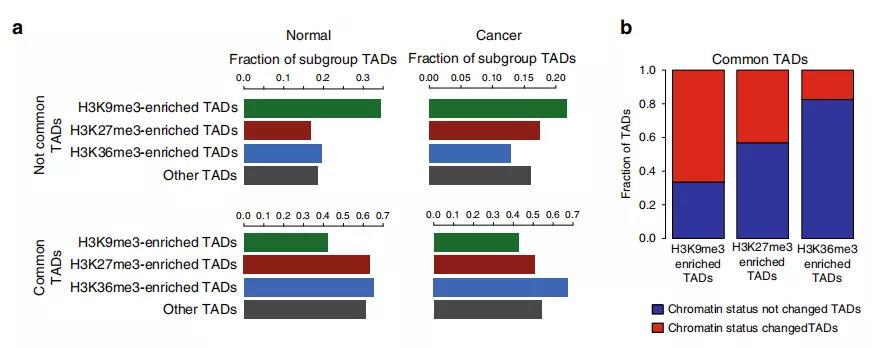
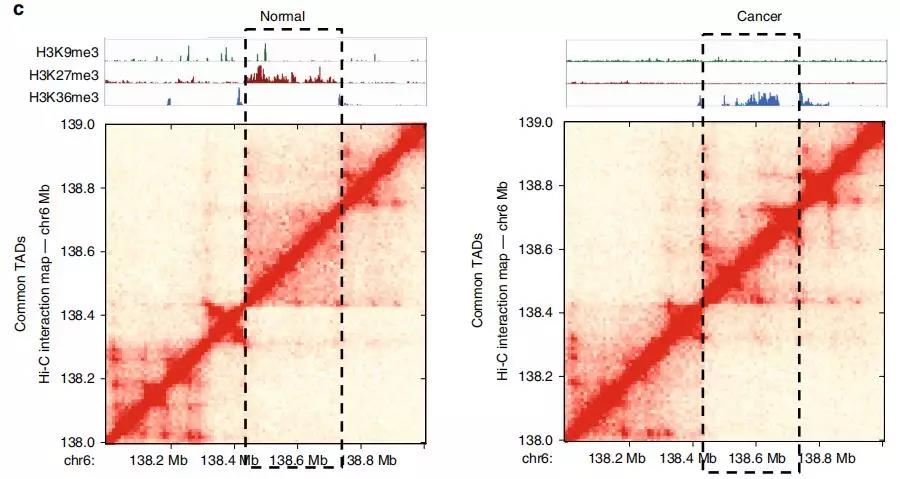
为研究TAD染色质状态的整体性质和表观遗传状态如何影响TAD内基因表达水平的信息,作者在正常细胞和前列腺癌细胞中使用 ChIP-seq进一步研究。研究发现在正常细胞中的大的TAD可能在肿瘤转化过程中分裂为较小的活性TAD,从而为以上提出的假说提供了支持,即正常特异性大的TAD可能包含使基因低表达的抑制因子。
此外,作者研究了在正常细胞和癌细胞之间共享边界的TAD。在变换了状态的TAD中确定约2000个基因,其中> 40%的基因表达水平显着改变;与未改变状态的TAD相比,改变的TAD中差异表达基因的数量增加了约50%。
Fig. 2 富含组蛋白标记的TAD亚群鉴定
Fig. 3前列腺癌细胞中改变表观遗传状态的TADs的鉴定。
3、前列腺癌细胞的增强子-启动子环
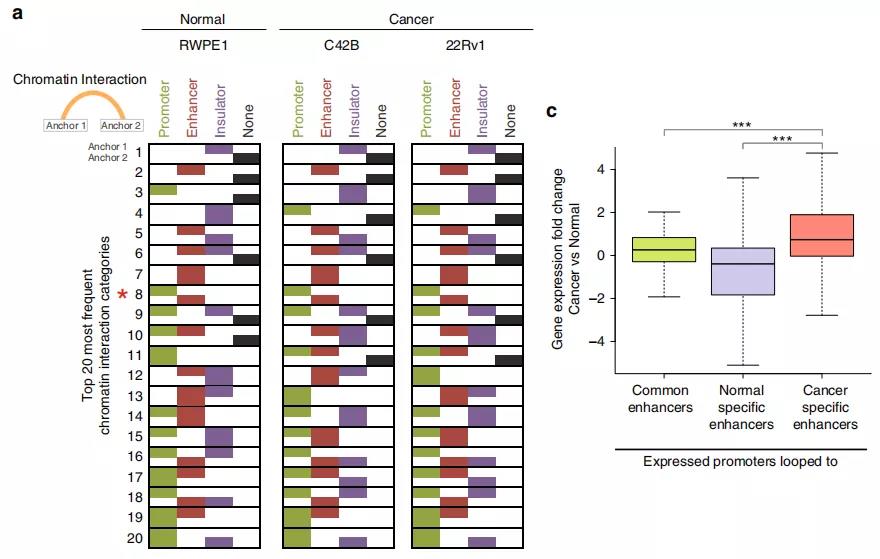
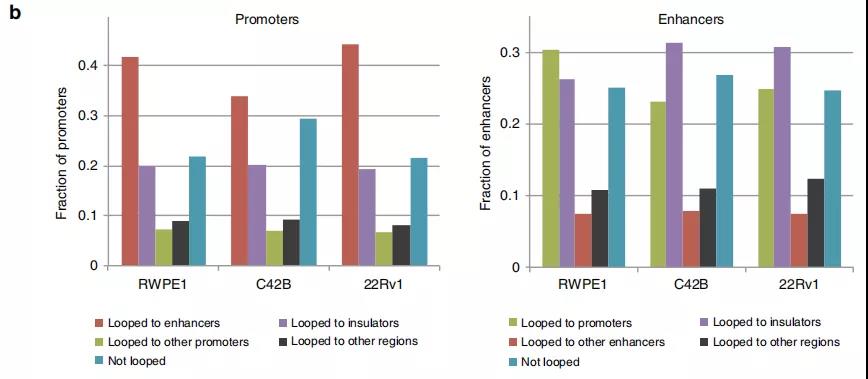
作者鉴定了正常细胞和前列腺癌细胞中染色质内的显著的loops,发现〜70%的启动子和增强子区域以及〜90%的CTCF峰与染色质相互作用锚重叠。与正常的增强子-启动子环调控的基因相比,癌症特异性增强子-启动子环调控的基因在癌细胞中显示出更高的基因表达,表明癌症特异性环有助于增强基因表达。
Fig. 4增强子-启动子环的鉴定。
4、细胞类型特异增强子-启动子环上的TFs
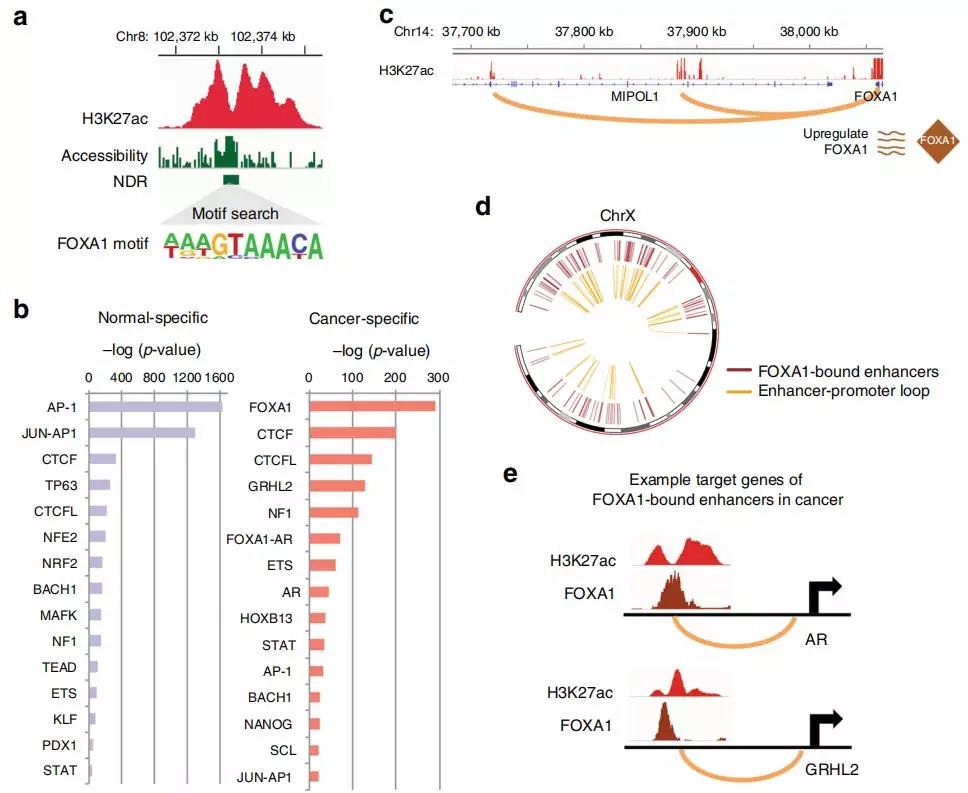
转录因子(TFs)是关键的调控因子,其通过与DNA调控元件结合,可以导致众多基因转录的变化。细胞类型特异性TFs与调节元件结合和HAT募集后,可产生区分细胞类型的H3K27ac表观基因组(增强子)图谱。作者使用NOMe-seq查找NDR,从RWPE1和C42B细胞的全基因组范围的H3K27ac峰中提取TF结合的基因组位置。结合RNA-seq分析和癌症基因组图谱(TCGA)基因表达数据集,作者发现了一个癌症特异TF基序FOXA1
,在C42B前列腺癌细胞增强子-启动环中的癌症特异性增强子的31%由FOXA1结合,它是癌症转录组的主要调节剂。增强子-启动子环不仅导致FOXA1表达增加,而且上调的FOXA1蛋白还通过介导许多其他的增强子-启动子环导致基因表达增加,从而助力于癌症的转录组。对启动子与FOXA1结合的增强子相连的基因研究显示,参与细胞周期的基因(例如CDK4,CDC23,MYC)以及雄激素受体(AR)和雄激素响应基因(例如GRHL2)是FOXA1结合的目标基因。
Fig. 5 在细胞类型特异性增强子上富集的TFs与启动子成环
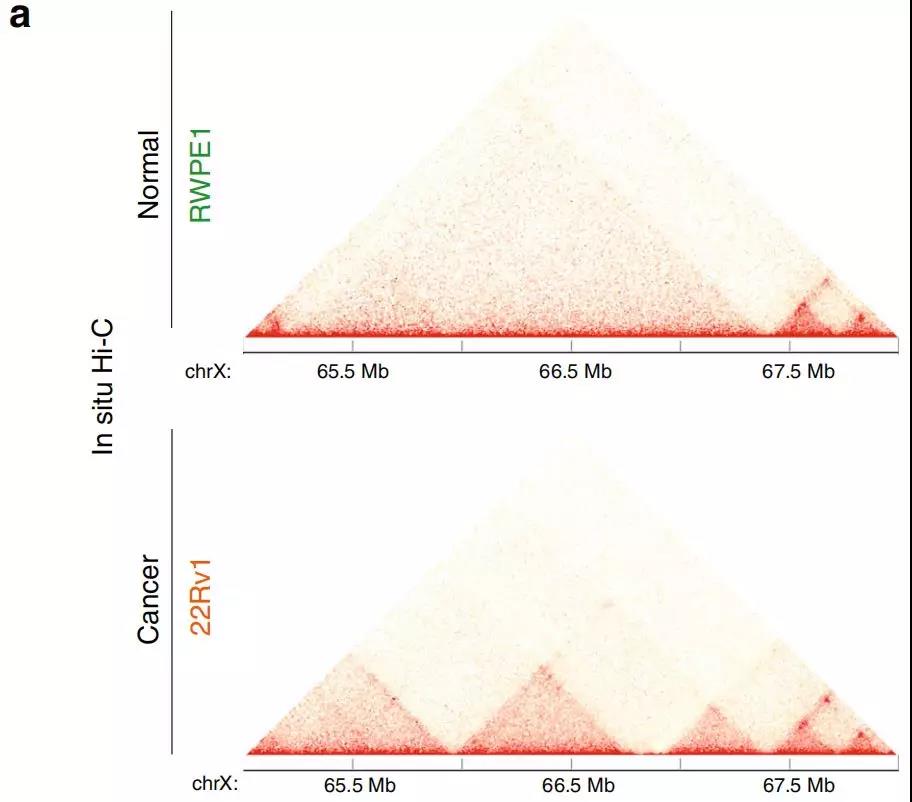
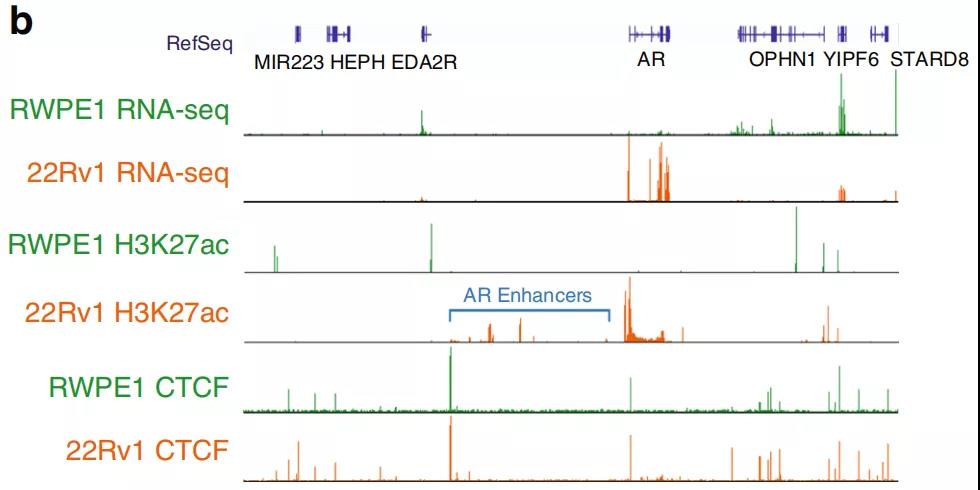
5、AR基因座周围的染色质结构
作者发现AR基因的增强子-启动子环对前列腺癌细胞具有特异性,原位Hi-C证明与RWPE1正常细胞相比,22Rv1前列腺癌细胞增强子-启动子的相互作用更频繁。在AR基因附近也有癌症特异性的小TADs(图6a)。H3K27ac ChIP-seq图谱显示,在22Rv1前列腺癌细胞中,AR基因启动子所在的TAD中发现的多种增强子具有活性,而在RWPE1正常细胞中则没有活性(图6b)。与RWPE1正常细胞相比,癌细胞中更大的染色质接触频率可能有助于上调22Rv1前列腺癌细胞中的AR表达。
Fig. 6 前列腺癌细胞AR位点周围染色质结构改变
研究总结:
作者使用原位Hi-C绘制正常细胞和前列腺癌细胞中的高分辨率染色质相互作用图谱,通过原位Hi-C和ChIP-seq、RNA-seq数据相结合确定正常细胞和前列腺癌细胞TADs的大小和表观遗传状态的改变相关。此外,作者在正常和前列腺癌中,确定了特异性增强子-启动子环和涉及的转录因子。例如,研究显示FOXA1富含前列腺癌特异性增强子-启动子环锚;在前列腺癌细胞中,雄激素受体(AR)基因座周围的染色质结构发生了改变,3D表观基因组图谱的创建使人们可以更好地了解前列腺癌生物学和基因调控机制。
1. 微量细胞建库:正常建库与生信分析的样本量可低至10万个核。
2. 高成功率:细胞样本文库构建成功率几乎为100%。
3. 建库周期短:只需执行两轮简单的消化和连接步骤即可获得高质量的文库。
4. 数据更准确:测序前质检,确保数据准确性
5. 分辨率更高:在测序数据量更少的情况下,互作矩阵分辨率更高,染色质结构分析得到的数据也更多
6. 较高的信噪比:使用多种措施来减少噪音,保证高质量的数据输出,分析更准确。
7. 量身定制个性化分析方案:提供DLO Hi-C的标准分析外,更注重与RNA-Seq、ChIP-Seq、ATAC-Seq和甲基化等多组学表观遗传分析,提供个性化的生信分析方案。
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:5875)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:6674)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:7888)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:5785)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:4630)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:6100)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:10095)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:6906)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5362)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5890)