
肿瘤代谢研究开始于上世纪中期,然而在过去几十年中,靶向肿瘤代谢治疗的进展十分缓慢。只有少数基于代谢的抗肿瘤药物正在或准备进行临床试验(表1)。随着对肿瘤代谢的研究,研究工作者认识到肿瘤药物设计框架必须考虑肿瘤免疫微环境(TIME)中非癌细胞的代谢脆弱性,以及癌细胞的代谢脆弱性。最近,免疫疗法强调了TIME中非癌细胞自主成分的重要性。靶向肿瘤代谢必须基于对特定代谢途径如何影响TIME细胞以及TIME细胞如何抑制或促进肿瘤进展的透彻理解。来自Wistar研究所和Ludwig肿瘤研究所的Chi V. Dang团队全面汇总了肿瘤代谢治疗相关进展及难点,相关成果发表于《Nature Reviews Drug Discovery》。

表1. 靶向肿瘤代谢的小分子药物
葡萄糖代谢:葡萄糖为生物合成提供了能量和碳骨架(图1,2)。为维持细胞稳态,葡萄糖通过糖酵解代谢为丙酮酸,丙酮酸通过线粒体丙酮酸载体进入线粒体。有研究发现线粒体丙酮酸载体具有肿瘤抑制作用,但线粒体丙酮酸载体可能不是开发肿瘤抑制剂的理想靶点。线粒体丙酮酸脱氢酶将丙酮酸转化为乙酰辅酶A(乙酰CoA),通过三羧酸(TCA)循环进一步氧化,最终生成草酰乙酸。草酰乙酸与新生成的乙酰CoA结合生成柠檬酸,补充代谢循环。碳骨架和ATP由糖酵解和线粒体氧化代谢产生,提供能量和构件以维持细胞完整性(图1,2)。
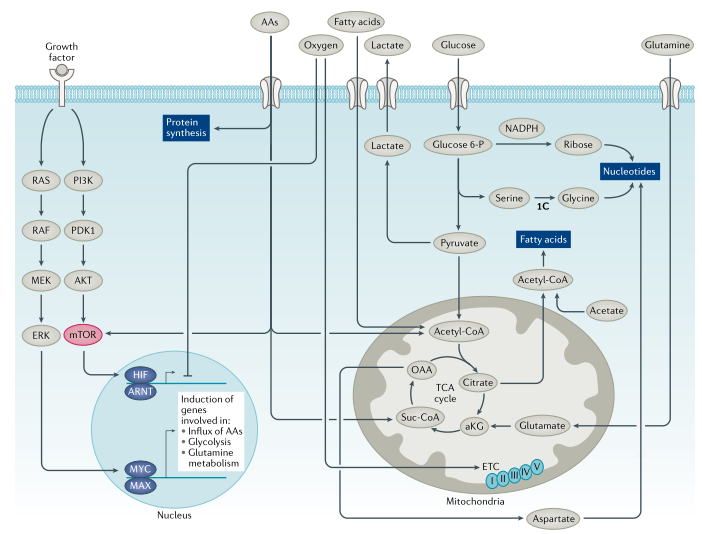
图1. 致癌因子调节肿瘤细胞代谢
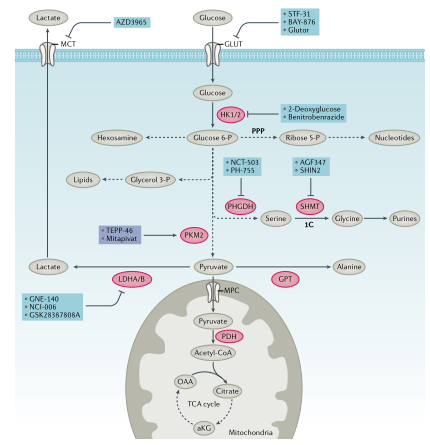
图2. 糖代谢和小分子抑制剂
氨基酸代谢:必需氨基酸(组氨酸、赖氨酸、蛋氨酸、苯丙氨酸、苏氨酸、色氨酸和支链氨基酸)在人体中不能从头合成。这些必需氨基酸和非必需氨基酸,如谷氨酰胺(图3)、丝氨酸和甘氨酸,通过各种转运蛋白进入细胞并用于一碳代谢、核酸和蛋白质合成。支链氨基酸可以通过线粒体支链α-酮酸脱氢酶复合物转化为酮酸,并生成琥珀酰CoA和乙酰CoA通过TCA循环进行氧化作用。TCA循环中间体草酰乙酸可以被转氨以产生天冬氨酸,精氨酸琥珀酸合成酶(ASS1)的缺失可导致天冬氨酸积累,ASS1通过消耗天冬氨酸将瓜氨酸转化成精氨酸琥珀酸。积累的天冬氨酸则通过核苷酸和天冬酰胺合成进而维持细胞增殖。
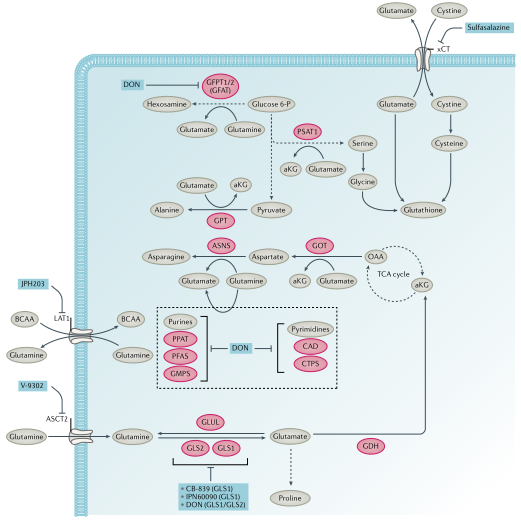
图3. 谷氨酰胺代谢和小分子抑制剂
脂肪酸代谢:膳食脂肪酸和胆固醇由肝脏包装并输送到外周组织进行摄取、储存或代谢。特别是,脂肪酸转运进入细胞并与脂肪酸结合蛋白结合,以脂滴形式储存或输送至线粒体或过氧化物酶体进行氧化(图1,4)。脂肪酸氧化提供了主要的能量来源。脂酰CoA通过线粒体膜结合的肉碱棕榈酰转移酶1(CPT1)转化为脂酰肉碱,并通过肉碱-酰基肉碱转位酶转运到线粒体中。然后脂酰-肉碱通过CPT2重新转化为脂酰CoA,进而被氧化成乙酰CoA,进入TCA循环进一步分解(图4)。

图4. 脂肪酸代谢和小分子抑制剂
核苷酸合成:肿瘤细胞的生长和增殖依赖于TCA循环中间体的从头合成核苷酸、来自戊糖磷酸途径(PPP)的葡萄糖衍生的核糖以及产生嘌呤和嘧啶核苷酸的氨基酸。一碳代谢对于核酸合成至关重要。叶酸是四氢叶酸(THF)合成必不可少的成分,并作为一碳载体,具有三种碳氧化态。亚甲基-THF(5,10-CH2-THF)通过胸苷酸合酶(TYMS)参与dUMP生成dTMP,TYMS可被化疗药物5-氟尿嘧啶的产物氟脱氧尿苷单磷酸(FdUMP)抑制。从头合成嘧啶由六个步骤组成(图5),伴随着线粒体二氢乳清酸脱氢酶(DHODH)的参与,它需要一个功能性电子传递链(ETC)用于泛醌介导的二氢乳清酸氧化成乳清酸。甲酰-THF(10-CHO-THF)提供一碳单位并参与嘌呤的11步从头合成。从头合成嘌呤时,来自甘氨酸、谷氨酰胺、天冬氨酸和叶酸载体的甲酰基的碳和氮原子依次添加到葡萄糖衍生的核糖上(图5)。嘧啶和嘌呤的从头合成对于生长和增殖的肿瘤细胞的mRNA合成和DNA复制至关重要(图5)。因此,这些途径包含多个潜在的治疗靶点。由于人类组织正常增殖也依赖这些途径,因此骨髓抑制、胃肠道粘膜炎和脱发是靶向核苷酸化学疗法的常见临床副作用。
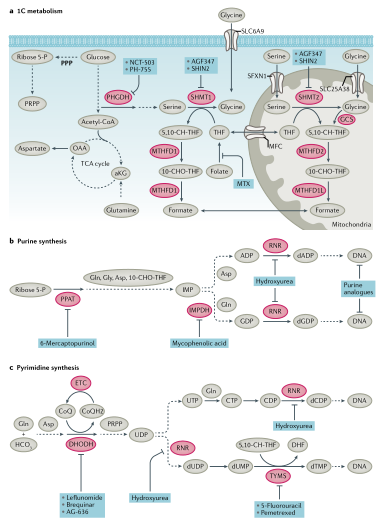
图5. 核苷酸代谢和小分子抑制剂
在触发RAS-RAF-MEK-ERK和PI3K-AKT-mTOR信号转导通路的细胞受体驱动下(图1),增殖细胞吸收营养物质和氨基酸,刺激mTORC1并通过诱导癌基因MYC和其他转录因子激活转录重编程。MYC加速了许多“管家”基因的表达,这些基因主要是代谢、线粒体和核糖体基因,允许生长信号的转录放大。新的转录本,特别是那些编码营养转运蛋白的转录本,被翻译以增加细胞生长和增殖所需的营养摄入。氨基酸进一步刺激mTORC1,促进蛋白质合成和核糖体合成,促进生长信号放大(图1)。从理论上讲,正常增殖细胞与肿瘤细胞的区别在于正常细胞感知营养缺乏并停止增殖的能力,而由癌基因驱动的生长失调的肿瘤细胞则依赖于营养。因此,营养剥夺可能会引发肿瘤细胞死亡,而正常细胞可能会退回到G0/G1细胞周期状态。
肿瘤细胞的代谢脆弱性:尽管肿瘤代谢的致癌激活使肿瘤细胞易受不同代谢途径的抑制,但这些途径也被免疫细胞利用,特别是在受体激活状态。因此,特定营养转运蛋白或酶的精确抑制可能会破坏TIME中抗肿瘤细胞对肿瘤细胞的精准靶向作用。事实上,细胞毒性T淋巴细胞(CTL)和自然杀伤(NK)细胞等抗肿瘤免疫细胞的代谢抑制可以减弱其他抗肿瘤方式效果。因此,应该在正常免疫系统下研究肿瘤治疗的靶向代谢策略,特别是实体瘤,例如胰腺癌,其包含的非肿瘤细胞比肿瘤细胞更多。相比之下,血液肿瘤,特别是依赖代谢快速增殖的急性白血病细胞,可能更容易受到代谢抑制。
目前多种方法发现肿瘤细胞的代谢脆弱性,包括靶向糖酵解、天冬氨酸、谷氨酰胺或脂肪酸代谢,或采用siRNAS、 shRNAs、CRISPR-Cas9进行基因编辑筛选。一项整合代谢组学和CRISPR–Cas9筛选的研究发现,天冬酰胺合成酶(ASNS)在实体瘤细胞系(如胃癌和肝癌细胞系)中存在细胞脆弱性,这表明L-天冬酰胺酶的治疗用途可以从ALL扩展到实体瘤。特定致癌突变也可能赋予选择性代谢脆弱性。肺癌小鼠模型中KEAP1突变可以影响谷氨酸\谷氨酰胺代谢, KRAS激活导致对支链氨基酸的代谢依赖性与胰腺癌不同。此外,MYC驱动的转基因小鼠的肺癌细胞可以表达谷氨酰胺合成酶,而MYC驱动的小鼠肝癌细胞则不表达该酶,说明细胞类型在强调不同肿瘤的特定代谢依赖性中的重要性。饮食对肿瘤代谢治疗敏感性方面的作用也在不同的小鼠肿瘤模型中得到证实,因为饮食会影响诸如丝氨酸或甘氨酸等营养物质的可用性。
基于代谢的药物开发
靶向代谢的一个关键因素是药物特异性。药物化学与结构生物学相结合,可用于开发高度特异性的药物,晶体学研究可以确认其与靶标的相互作用。其中,有几种高度特异性的代谢抑制剂作用于催化位点和变构位点(图6)。靶向活性位点的一个关键挑战是代谢酶中普遍存在的疏水口袋,因此,变构抑制剂可能具有更好特异性。肿瘤细胞会重构代谢途径,造成耐药性产生,也会降低精准靶向治疗的效果。因此,联合疗法或阻断多种途径的疗法可能比单药疗法具有优势。因此,酶或转运蛋白特异性抑制剂的研究应该联合药物化学、结构生物学、药代动力学和药效学研究。

图6. 与小分子抑制剂结合的酶或转运蛋白的结构
代谢靶点
1.有氧糖酵解:抑制葡萄糖摄取是一种治疗方法。STF-31是一种葡萄糖转运蛋白1(GLUT1)的小分子抑制剂,体内实验证明其具有抗肿瘤效应,但它具有脱靶效应。STF-31还可抑制烟酰胺磷酸核糖转移酶(NAMPT),添加烟酸或表达耐药NAMPT突变体可赋予STF-31抗性,这表明GLUT1抑制不是STF-31抑制肿瘤的唯一靶点。Glutor可靶向作用于GLUT1、GLUT2和GLUT3抑制糖酵解。BAY-876可降低ATP产生。己糖激酶是糖酵解的第一步, HK2缺失可降低体内肿瘤发生。一系列HK2抑制剂进行了开发和应用,如3-溴丙酮酸、葡萄糖胺衍生物、benitrobenrazide。丙酮酸激酶是另一种关键的糖酵解酶,分为PKM1、PKM2、PKLR。非小细胞肺癌(NSCLC)研究中PKM2抑制剂被认为可以通过减少葡萄糖到乳酸的通量来改变生物合成,从而发挥抗肿瘤作用。不过,有些肿瘤中PKM2不会发生变化,因此PKM2抑制因子或激活因子(TEPP-46)在肿瘤治疗方面还需进一步研究。乳酸脱氢酶以LDHA和LDHB同源四聚体和异源四聚体形式存在,对Warburg效应至关重要。抑制LDHA和LDHB可能都具有治疗作用,不过大多数尝试都针对LDHA,尽管已经开发了几种有效的LDHA抑制剂,但小分子对其选择性抑制的成功率有限。尽管关于乳酸作为肿瘤燃料存在争议,但SLC16A家族成员单羧酸转运蛋白1(MCT1)或MCT4的阻断会导致细胞内乳酸积累,从而减少NADH向NAD+的再循环并抑制糖酵解。因此,抑制MCT1或MCT4可能具有抗肿瘤作用。
2.谷氨酰胺代谢:谷氨酰胺是体内水平较高的一种非必需氨基酸,血浆水平为0.5mM,比葡萄糖高出10倍。谷氨酰胺通过丙氨酸-丝氨酸-半胱氨酸转运蛋白(ASCT2)主动运输到细胞中,然后通过线粒体谷氨酰胺酶GLS1和GLS2脱氨作用转化为谷氨酸,进而通过谷氨酸脱氢酶或谷氨酸-草酰乙酸转氨酶(GOT)或GPT转氨酶转化为α-酮戊二酸,随后进入TCA循环正向循环至琥珀酸或通过还原羧化转化为异柠檬酸。ASCT2拮抗剂V-9302具有抗肿瘤作用,也被证明可通过增强T细胞活化抑制乳腺癌。此外,V-9302与谷氨酰胺酶抑制剂CB-839联合使用可减少人肝癌异种移植物的生长。与V-9302的抗肿瘤活性及其对L型氨基酸转运体1(LAT1)依赖的中性氨基酸转运的抑制一致,LAT1在KRAS突变的结直肠癌(CRC)模型中被发现对肿瘤的发生至关重要。此外,LAT1抑制剂JPH203显示出对HT-29CRC异种移植具有一定效果,它目前正在向II期临床研究推进。
3.脂肪酸合成:尽管某些肿瘤依赖于脂肪酸氧化,但缺乏高度特异性的脂肪酸氧化抑制剂。使用stomoxir抑制脂肪酸氧化具有脱靶效应,但是其对MYC诱导型乳腺癌小鼠具有抑制作用。ST1326是肉碱棕榈酰转移酶1(CPT1,通过产生脂酰肉碱在脂肪酸氧化中起关键作用)的抑制剂,在体内对MYC诱导的小鼠淋巴瘤模型具有抗肿瘤活性;但ST1326是否有脱靶效应尚不清楚。肿瘤细胞对脂肪氧化与脂肪酸合成的依赖性还需要进一步明确。肿瘤细胞依靠脂肪酸从头合成来生长和增殖,因此推测易受脂肪酸合成酶的抑制。柠檬酸从线粒体输出到细胞质中,通过ATP-柠檬酸裂解酶(ACLY)转化为乙酰CoA,是脂肪酸链延长的关键来源。ACC1和ACC2产生丙二酰辅酶A,经FASN延长生成硬脂酸盐,经SCD1产生油酸盐。ACLY是小鼠肿瘤模型发生发展所必需的,已报道,高活性ACLY抑制剂在肺癌和前列腺癌的异种移植模型中具有抗肿瘤功效。此外,还发现了一系列具有低竞争性抑制活性的ACLY变构抑制剂,但ACLY抑制剂对肿瘤模型的体内疗效尚未报道。乙酰CoA合成酶(ACSS2)可以将醋酸盐生成乙酰CoA,并且可以绕过ACLY抑制,因此它一直是药物开发的靶点。在由MYC激活和PTEN缺失驱动的两种人类肝细胞癌模型中,ACSS2敲除小鼠的肿瘤负荷减少。且ACSS2敲除小鼠没有表现出任何表型缺陷,这表明ACSS2抑制剂的安全性。shRNAs或CRISPR的ACSS2敲除也可抑制体内肿瘤发生。这些研究表明ACSS2抑制可能具有有益的抗肿瘤作用。
乙酰CoA的产生是脂肪酸合成的第一步,然后是乙酰CoA羧化酶(ACC)产生丙二酰CoA,这也是肿瘤发生所必需的。使用低效ACC1抑制剂TOFA可以抑制MYC诱导的肾肿瘤。与ACC1敲除结果一致,ACC1抑制剂ND-646显示可抑制肿瘤脂肪酸合成和体内A549异种移植物和KRAS驱动的肺癌发生发展。由ACC产生的丙二酰CoA被脂肪酸合成酶(FASN)进一步延长。几十年来,FASN一直是备受关注的靶点。质子泵抑制剂奥美拉唑为一种弱效非特异性FASN抑制剂,而更有效的FASN抑制剂C75已在临床前研究中显示具有抗肿瘤作用。据报道,FASN抑制剂AZ22和AZ65可抑制2D和3D乳腺癌和前列腺肿瘤细胞培养物以及体内乳腺癌异种移植物的生长。此外,SCD1的抑制将导致细胞应激和细胞生长停滞或死亡,使其成为潜在的癌症治疗靶点。
4.核苷酸代谢:临床上被批准的代谢药物大多是靶向核苷酸代谢,特别是中断DNA合成。Sidney Farber开发的抗叶酸疗法是第一个靶向代谢的抗肿瘤疗法,近些年一碳代谢又重新引起关注。甲氨蝶呤靶向二氢叶酸还原酶(DHFR)在肿瘤化疗中发挥了关键作用。培美曲塞靶向胸苷酸合成酶(TYMS)和5-氨基咪唑-4-甲酰胺核糖核苷酸(AICAR)转化酶,用于非小细胞肺癌(NSCLC)治疗。丝氨酸和甘氨酸通过介导一碳代谢对核苷酸合成也很重要。丝氨酸可由3-磷酸甘油酸通过磷酸甘油酸脱氢酶(PHGDH)和磷酸丝氨酸氨基转移酶1(PSAT1)合成。从头合成的丝氨酸经丝氨酸羟甲基转移酶(SHMT1和SHMT2)转化成甘氨酸。甘氨酸通过甘氨酸裂解系统向THF提供一个甲基,THF向胸腺嘧啶和嘌呤的合成提供1C。PHGDH是催化丝氨酸从头合成的第一个限速步骤,研究发现PHGDH在4%的黑色素瘤和胰腺癌病例中出现扩增,并且已经开发出PHGDH抑制剂来中断肿瘤一碳代谢和核苷酸代谢。目前已经开发的PHGDH抑制剂(包括酮硫酰胺、BI-4924、吲哚酰胺、哌嗪-1-硫脲基抑制剂和变构抑制剂)均具有抗肿瘤效果。不过,目前还没有一种PHGDH抑制剂进入临床研究。针对细胞质SHMT1、线粒体SHMT2、嘌呤或嘧啶代谢酶(如IMPDH、DHODH)抑制剂也在开发中。
5.线粒体:线粒体是一种呼吸和代谢细胞器,对肿瘤发生至关重要,因此是一个具有吸引力的靶点。然而,直接针对其呼吸活动是一项重大挑战。二甲双胍和苯乙双胍因乳酸酸中毒而被停用,它们是靶向线粒体复合物I的双胍类药物,目前在临床上用于治疗糖尿病。更强效的双胍类药物IM156对MYC诱导的小鼠淋巴瘤具有治疗效果。IM156已在实体肿瘤和淋巴瘤的I期临床试验(NCT03272256)中进行研究,II期研究正在等待中。
靶向TIME相关代谢
肿瘤代谢领域的里程碑是FDA批准突变IDH2和IDH1抑制剂用于AML治疗。其他值得注意药物研究包括CPI-613、谷氨酰胺酶抑制剂CB-839、DRP-104 DON前体药物 (NCT04471415)。然而,除了DRP-104之外,这些药物对肿瘤微环境的影响尚不清楚。TIME是复杂的,并且随着肿瘤细胞、基质细胞、免疫细胞等细胞组成改变而变化。TIME间代谢相互作用关系仍知之甚少,还需不断积累。值得注意的是,肿瘤细胞可以产生各种免疫抑制代谢物,如腺苷、2-羟基戊二酸、犬尿氨酸、乳酸和甲硫腺苷等,它们对肿瘤免疫治疗造成障碍。不同的肿瘤类型在TIME组成上也有所不同——增生性胰腺癌中富含大量基质细胞,而白血病则是大量循环肿瘤细胞。基质细胞可以提供营养,而免疫细胞可以抑制由CD8+CTL和NK细胞介导的抗肿瘤免疫反应。因此,靶向代谢治疗需要在肿瘤细胞和免疫细胞中找到协同的靶点,产生协同效应。而研究靶向各种代谢酶如何影响TIME中各类细胞功能至关重要。
未来方向
迄今为止,许多代谢酶已被作为肿瘤治疗的靶点,但特定肿瘤类型对特定抑制剂的脆弱性仍有待进一步研究,无论是单一药物还是联合化疗、放疗、靶向疗法(如激酶抑制剂)或免疫疗法。当靶向特定的代谢酶时,代谢可塑性仍是一个挑战。无论未来采如何,靶向肿瘤治疗既能使肿瘤细胞失能,又能协同增强抗肿瘤免疫才是最理想的结果。
参考文献
Targeting cancer metabolism in the era of precision oncology. Nat Rev Drug Discov. 2022.
请扫描下方二维码阅读原文

绘谱帮你测
肿瘤代谢的重要性越来越受到关注。靶向代谢组学可对生物样品中的数千个小分子进行全面、系统的分析,可以灵敏捕捉到机体代谢的细微变化,是寻找疾病生物标志物或药物靶标的有力工具。麦特绘谱拥有成熟的代谢物定性和定量平台,开发出Q600、Q300全定量代谢组、宏代谢组、能量代谢,以及同位素示踪/代谢流等不同的靶向代谢组检测方法,致力于提供肿瘤代谢研究多角度解决方案,详情欢迎咨询麦特绘谱热线400-867-2686。
END
往期推荐 >>>
2. Gut丨角鲨烯环氧酶通过促进细胞增殖和肠道菌群失调加速CRC进展
3. 客户案例 | 甘草酸二铵通过调节肠道菌群-结合型胆汁酸-FXR信号通路改善肥胖
4. Advanced Science | 多组学揭示肝脏脂肪变性中菌群对宿主代谢的影响
5. Nature Communications | 肠道菌-胆汁酸代谢作用有效减轻节食后体重反弹

