步骤1:机制研究
a) 小鼠模型研究SR后残余肿瘤生长情况、小鼠生存情况;
b) RNA-Seq、多色免疫荧光染色(PIF)和流式细胞(FCM)检测研究SR后免疫抑制TME的形成机制;
步骤2:纳米药物IPI549@HMP的制备及表征
a) IPI549@HMP的制备及理化性质分析;
b) 体内、体外实验评价IPI549@HMP的放疗增敏效应及药代动力学和安全性;
步骤3:疗效评估
a) 荷瘤小鼠静脉注射IPI549@HMP治疗,分析纳米药物对SR后残余肿瘤生长的抑制效果;
b) 荷瘤小鼠接受不同疗法后,与免疫反应相关细胞类群和分子标记物的检测;
c) 模拟肿瘤细胞远端转移实验,研究不同疗法对肿瘤转移灶的抑制作用;
d) 模拟继发性肿瘤接种实验,研究不同疗法对肿瘤复发的抑制作用。
研究结果
1. 机制研究:SR驱动的免疫抑制加速了局部肿瘤进展
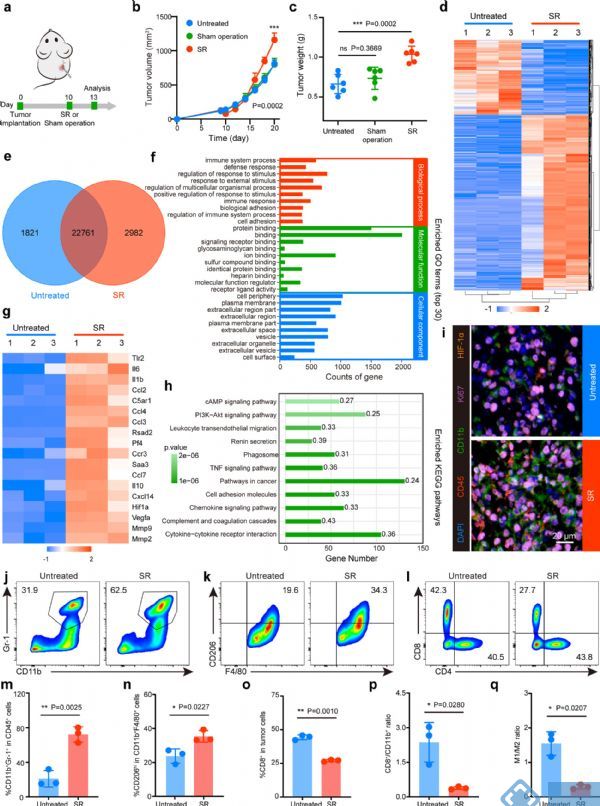
小鼠接种肿瘤细胞10天后进行SR处理,同时设置未处理组和假手术组对照。相比未处理组,SR处理后小鼠肿瘤起初减少,但后期肿瘤生长加速,最终比对照组小鼠肿瘤更大(图1 a-c),这些结果表明SR后残留肿瘤的存在加速了癌症进展。RNA-Seq数据表明,SR后残留肿瘤中引发复杂的炎症反应和缺氧,最终诱导了术后局部免疫抑制TME(图1 d-h)。PIF和FCM检测结果进一步证实SR诱导了以缺氧和骨髓细胞的大量浸润为特征的免疫抑制TME,从而促进了癌症进展(图 1i-q)。
图1 SR驱动的免疫抑制加速了局部肿瘤进展
2. 材料制备:基于HMP的纳米系统的合成与表征
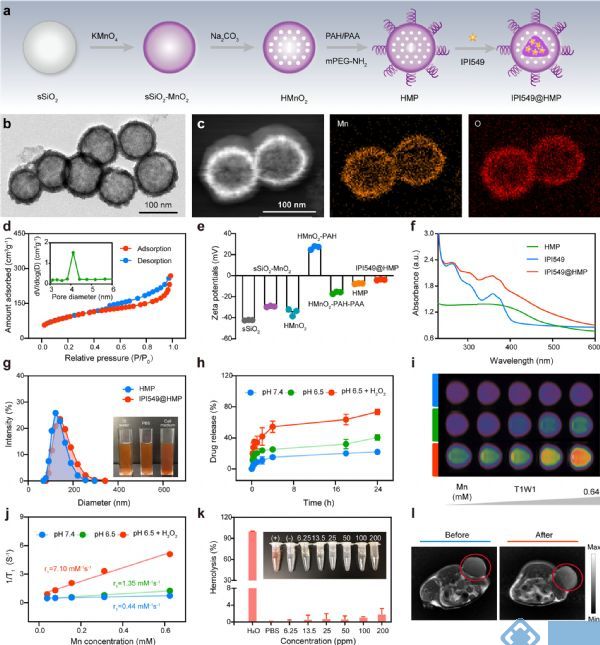
如图 2a所示,设计合成纳米药物IPI549@HMP用于进一步实验。理化实验检测结果表明IPI549@HMP可作为有效载药的理想纳米载体,并具有超灵敏TME响应药物释放效率。体内和体外实验结果进一步证明IPI549@HMP为低毒性纳米颗粒,可以安全地静脉内给药;此外IPI549@HMP还具备高生物相容性及出色的肿瘤特异性磁共振成像能力(图 2b-i)。
图2 基于HMP的纳米平台的原理图和特性
3. IPI549@HMP疗效评估
3.1 IPI549@HMP + , RT抑制术后肿瘤进展
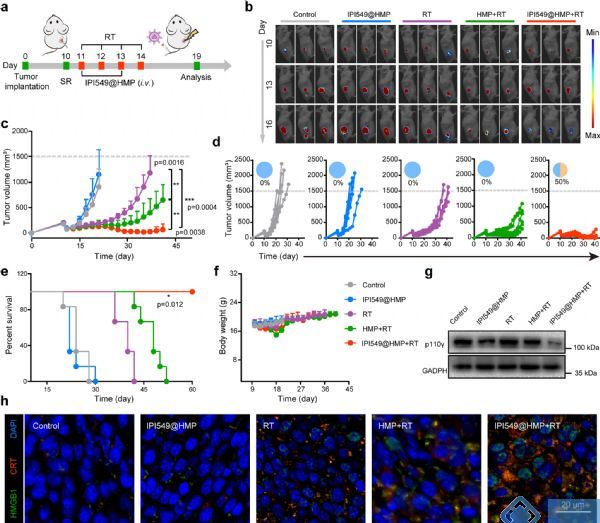
对CT26荷瘤小鼠(结直肠癌模型)静脉注射IPI549@HMP治疗后,体内光声成像、血氧饱和O2检测和HIF-1α染色结果证实IPI549@HMP具备出色的靶向肿瘤富集和缓解肿瘤缺氧状态的能力。此外,肿瘤术后复发小鼠模型经IPI549@HMP联合RT治疗后,残留肿瘤的生长速度最慢,所有小鼠均存活60天,完全缓解率为50%(图 3a-f)。这一疗效在黑色素瘤小鼠模型中得到了验证。
图3 IPI549@HMP + RT抑制术后肿瘤进展
3.2 IPI549@HMP + RT改善术后免疫微环境
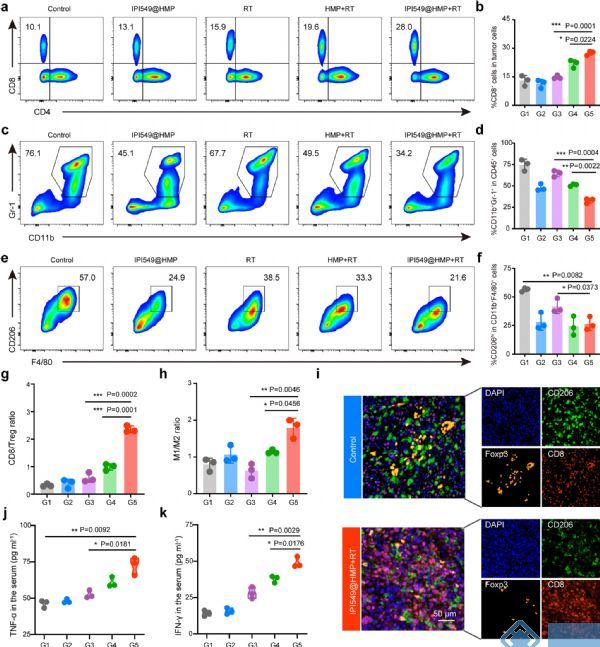
WB和免疫荧光染色实验结果显示IPI549@HMP联合RT治疗能够抑制PI3Kγ、促进CRT和HMGB1的表达,这些结果表明联合治疗的良好疗效是由于增强免疫原性细胞死亡效应和逆转免疫抑制的协同作用(图 3g、h)。FCM分析显示,IPI549@HMP联合RT疗法有效提高了肿瘤浸润性CD8+ T细胞的浸润并减少了骨髓来源的抑制细胞(MDSC)的募集(图 4a-f)。抗肿瘤免疫稳态指标CD8/Treg、CD8/MDSC及M1/M2比率显著改善,PIF分析进一步证实了这些结果(图 4g-i)。此外,IPI549@HMP 联合RT治疗后小鼠血清TNF-α和IFN-γ分泌水平上升,表明这种放射免疫治疗策略能够引发强烈的免疫反应(图4j、k )。
图4 由IPI549@HMP增强RT触发的强大抗肿瘤免疫反应
3.3 IPI549@HMP + RT + PD-L1引发远隔效应
考虑到转移是大多数肿瘤术后复发患者的死亡原因,理想的术后治疗不仅需要抑制原发残余肿瘤,还应该能够控制或清除转移灶。双侧CT26荷瘤小鼠模型实验表明,单独注射的抗PD-L1(aPD-L1)对原发性和远处肿瘤的抑制几乎没有效果,IPI549@HMP + RT疗法可以在一定程度上抑制原发性肿瘤的生长,但不能对远处肿瘤产生影响。而IPI549@HMP + RT + aPD-L1疗法不仅能根除原发性残留肿瘤,并且还显著抑制了远处肿瘤的生长(图 5a-e)。此外,FCM和FIP实验结果表明IPI549@HMP + RT + aPD-L1治疗后,小鼠模型肿瘤相关的细胞和分子特征显著改善(图 5f-p)。这些结果表明IPI549@HMP + RT + aPD-L1疗法可以进一步产生强大的全身抗肿瘤免疫反应,这对于引发远隔效应至关重要。
图5 IPI549@HMP增强RT + PD-L1阻断的远隔效应
3.4 长期免疫记忆效应
作为适应性免疫的标志,免疫记忆效应可以长期保护机体抵御二次病原体攻击,这对肿瘤的预防至关重要。在联合治疗后第46天接种了继发性CT26肿瘤来评估IPI549@HMP + RT + aPD-L1治疗产生的免疫记忆效应(图 6a )。与对照小鼠中观察到快速的肿瘤进展相比,联合免疫疗法处理后的小鼠中没有观测到继发性肿瘤生长并且都存活了100天。此外,联合免疫疗法处理后小鼠效应记忆T细胞(Tem)比例和血清细胞因子分泌水平显著提升。这些结果表明联合免疫疗法处理小鼠具有显著的免疫记忆效应,并建立了强大的抗肿瘤免疫反应,持久保护小鼠以防止肿瘤复发(图 6b-j)。