126/science.1090521" style="color: rgb(0, 107, 180); text-decoration-line: none;">https://www.science.org/doi/10.1126/science.1090521
3. Biotechnology Industry Organization (BIO) analysis, 2012.
4. FDA, Innovation or stagnation: challenge and opportunity on the critical path to new medical technologies. March 2004.
5. Hellerstein, M.K. 2008. A critique of the molecular target-based drug discovery paradigm based on principles of metabolic control: advantages of pathway-based discovery. Metab Eng, 10(1), 1-9. https://doi.org/10.1016/j.ymben.2007.09.003
6. Hellerstein, M.K. 2003. In vivo measurement of fluxes through metabolic pathways: the missing link in functional genomics and pharmaceutical research. Annu Rev Nutr, 23, 379-402. https://doi.org/10.1146/annurev.nutr.23.011702.073045
7. Turner, S.M.; Hellerstein, M.K. 2005. Emerging applications of kinetic biomarkers in preclinical and clinical drug development. Curr Opin Drug Discov Devel, 8(1), 115-126. https://www.x-mol.com/paper/1212977911043006473?adv
8. Hellerstein, M.K. 2008. Exploiting complexity and the robustness of network architecture for drug discovery. J Pharmacol Exp Ther, 325(1), 1-9; https://doi.org/10.1124/jpet.107.131276
9. Shankaran, M.; King, C.; Lee, J.; et al. 2006. Discovery of novel hippocampal neurogenic agents by using an in vivo stable isotope labeling technique. J Pharmacol Exp Ther, 319(3), 1172-1181. https://doi.org/10.1124/jpet.106.110510
10. Fanara, P.; Wong, P.Y.; Husted, K.H.; et al. 2012. Cerebrospinal fluid-based kinetic biomarkers of axonal transport in monitoring neurodegeneration, J Clin Invest, 122(9), 3159-3169. https://www.jci.org/articles/view/64575
11. Potter, W.Z. 2012. Mining the secrets of the CSF: developing biomarkers of neurodegeneration. J Clin Invest, 122(9), 3051-3053. https://www.jci.org/articles/view/65309
12. Price, J.C.; Khambatta, C.F.; Li, K.W.; et al. 2012. The effect of long term calorie restriction on in vivo hepatic proteostatis: a novel combination of dynamic and quantitative proteomics. Mol Cell Proteomics, 11(12), 1801-1814. https://doi.org/10.1074/mcp.M112.021204
在新兴的定制化医疗时代,稳定同位素标记与强大的质谱分析技术的结合正在为药物开发和临床诊断提供越来越重要的诊断工具。
问题:当代药物开发中的高流失率
虽然人们普遍认为我们生活在一个新药研发生产突破的黄金时代,但事实恰恰相反。近年来,尽管制药行业投资大幅增加,但新药批准率仍达到了一直以来的最低水平[1]。这些令人失望的情况适用于所有类别的疾病,但尤其令人担忧的是日益流行的慢性疾病,如阿尔茨海默病、糖尿病、骨关节炎和肥胖相关疾病。这个问题的出现不在于缺乏分子靶点或候选药物。基于分子靶点的药物发现方法在过去20年的药物研究中占据主导地位,它产生了大量的基因、蛋白质和潜在的药物疗法。问题是药物线索的减损率变得更糟,而不是更好,现在98%的线索由于疗效或安全性原因而失效,包括人体试验中90%的失败率[2,3]。这种减损在很大程度上导致了最终批准的每一种成功药物的高成本。
药物复杂网络中的难以预测性
药物线索的减损,其主要原因是由生命系统组成的复杂网络的不可预测性组成的,而这些网络是对特定节点的针对性干预措施做出反应的[2],在这些系统中,有针对性的干预措施会带来意想不到的功能后果(可能是有害或者是有益的),这是非常常见的情况而非特例(图1)。每种疾病中个体之间的致病异质性放大了这一问题,因此需要针对不同患者亚群采取不同的干预策略。后一个问题体现在私人定制化医疗的理念上。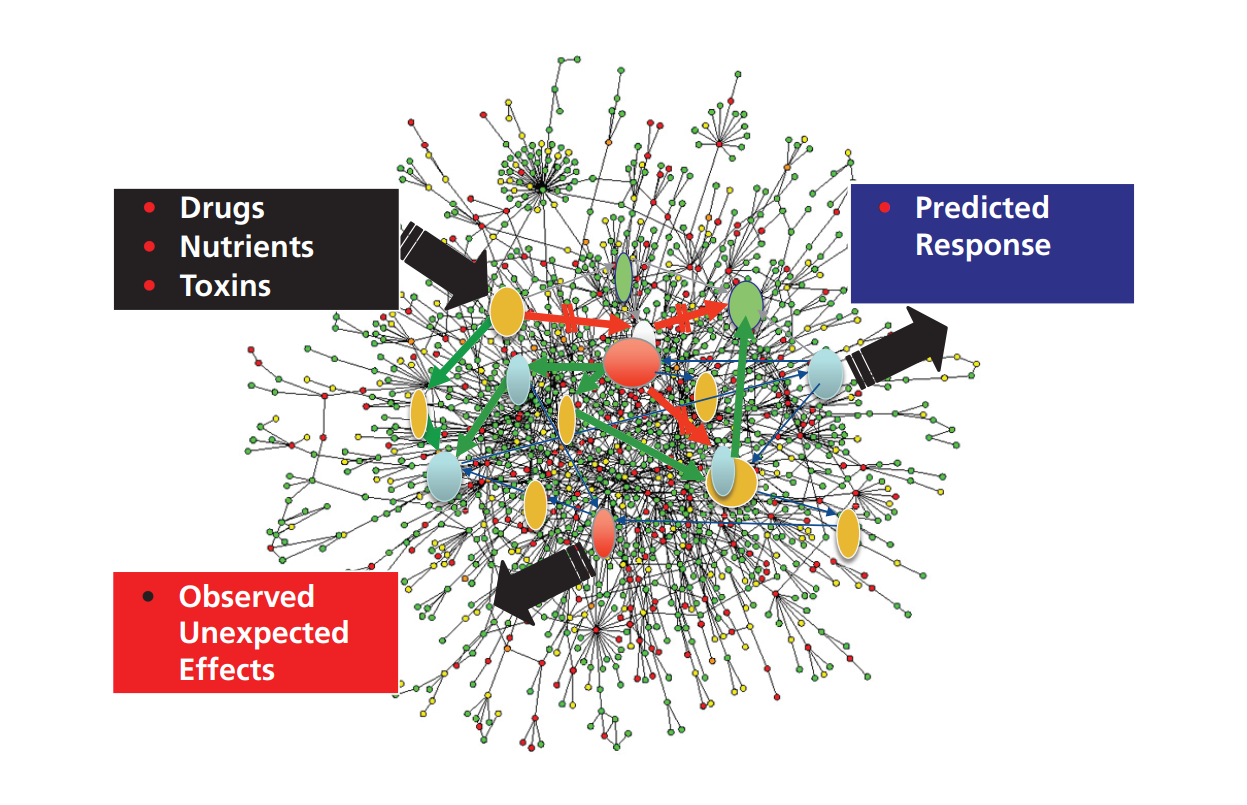
图1:药物复杂网络中的难以预测性。
缺失的一环:探索疾病复杂生物学的指标
在了解疾病的复杂生物学过程中,关键缺失的因素是指导药物研发人员朝着安全有效结局目标前进的客观指标[4]。这些指标被称为生物标记物,必须能够预测临床结局,并且可以从临床前模型转化到人类。实现这些目标的最可靠方法是捕获驱动每种疾病的基础生物学过程(即疾病修饰通路或基础发病机制)。这类指标可用于指导合理的药物发现和开发,并用于监测临床应答情况。
“定制化医学”领域对功能信息生物标记物的需求最大,即正确的患者、正确的药物、正确的时间和正确的剂量。伴随诊断检查是这一趋势的价值极高的例子。
稳定性同位素对于一类新型生物标记物至关重要:通过揭示基础疾病过程的功能可解读信息来预测临床检测的结果
我们需要能够预测临床结果的一类新型生物标记物[4,5]。构成慢性疾病基础的生物学通路(负责疾病启动、进展、严重程度和治疗逆转的因果过程)通常涉及分子流动,而这一通路本身复杂,且受到许多因素的影响(图2)[5-8]。稳定同位素技术已使所有这些因果通路在高等生物中可测量。
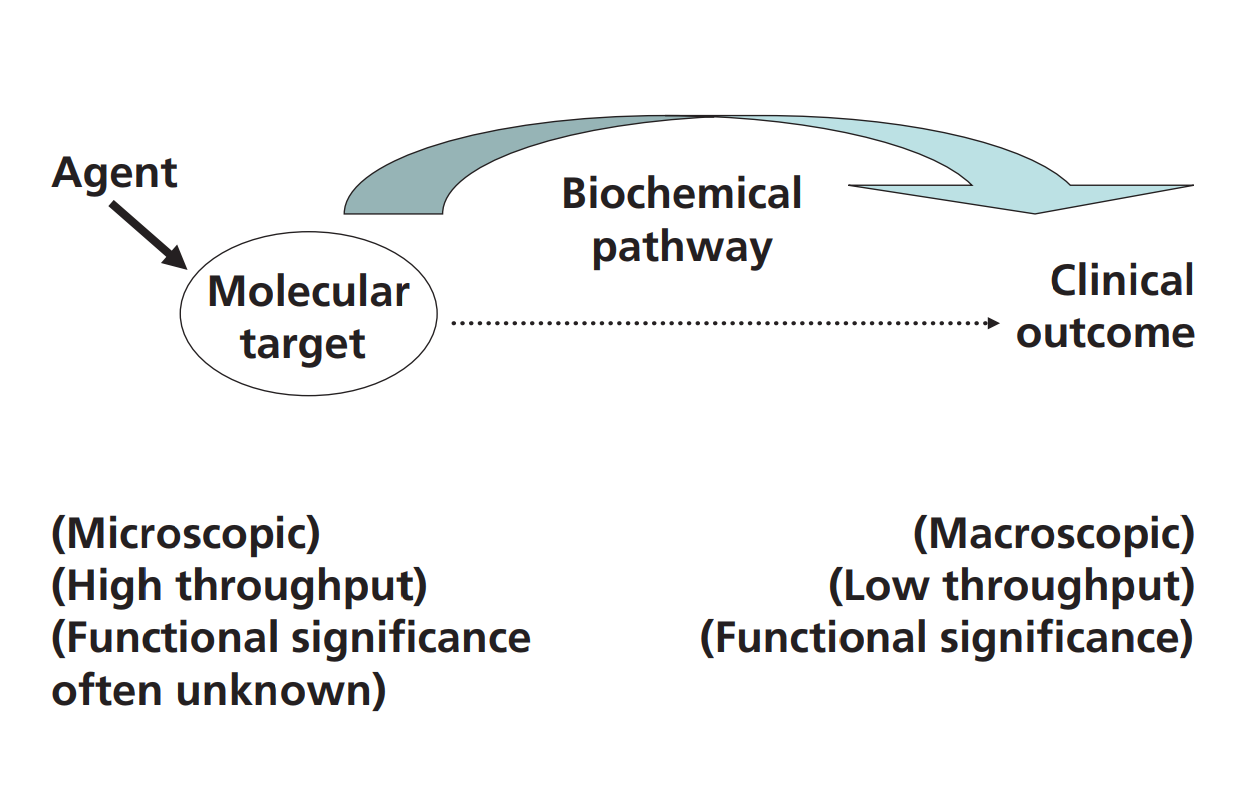
图2:通路通量作为分子靶点和临床结果之间的联系。稳定同位素为诊断生物标记物带来了什么
稳定同位素允许测量通过代谢途径的通量和全球生化网络的动态,且无毒性,通常无创,原因有二:第一,稳定同位素的实验性施用在时间维度上引入了“不对称”(本身没有标记,随后加入标记),这使得动态过程耗费的时间可以被测量;其次,过去一个世纪的生化研究已经建立了连接细胞和生物体分子的途径,使得标记底物在体内的运动行为得以被追踪。
重要的是,稳定同位素已经在人类和实验动物中使用了70多年,几乎没有已知的毒性。FDA对稳定同位素标记产品的政策是明确的,并且几十年来一直是一致的:除了管理其天然丰度同系物(无菌性、无热原性等)所需的审批之外,管理稳定同位素标记的化合物不需要任何监管批准。需要注意的是,稳定同位素质谱生物标记物不是放射成像技术,但需要来自身体的样本(血液、尿液、脑脊液、组织、唾液)。
两大类基于稳定同位素的可用动力学生物标记物
有两大类基于稳定同位素的生物标记物,它们在药物开发和诊断中是最有用的:(1)靶向因果途径的动力学,以及(2)网络动力学的研究,以无偏倚地发现动力学特征和其无法被预测的因果途径。这两种类型在药物发现和开发中都是有效的[5-15]。
作为药物发现和开发生物标记物的靶向因果通路动力学
表1列出了疾病致病途径的一些常见例子。其中包括:纤维化疾病中胶原和细胞外基质的合成;多发性硬化的髓鞘合成和代谢;阿尔茨海默病中淀粉样斑块的周转和淀粉样β1-42的合成;肌少症患者肌肉肌球蛋白合成及线粒体生物发生的研究肿瘤血管生成与肿瘤细胞增殖和死亡;在神经退行性疾病中通过轴突运送分子;亨廷顿病、帕金森病和其他以蛋白质聚集为特征的疾病中的自噬流;血栓栓塞性疾病中的凝块形成和溶解;胰岛素抵抗状态下胰岛素介导的葡萄糖摄取与胰岛β细胞增殖肥胖时脂肪组织脂质动力学及重塑;动脉粥样硬化中的胆固醇逆向转运;炎症状态下补体级联的激活;艾滋病患者的HIV复制和CD4+ T细胞的转换等其他案例。
测量被认为在疾病中起因果作用的任何功能相关过程的活动的能力,对这些领域的药物发现和开发具有潜在的变革作用(如帕金森病)[10,11]。
A) 神经生物学 |
通过轴突进行的递送 | 淀粉样β蛋白合成和斑块周转 | 神经发生 |
髓鞘形成/髓鞘再生 | 神经递质释放和周转 | 神经元线粒体生物发生 |
神经炎症,小胶质细胞的活化 | 细胞因子释放 | 亨廷顿蛋白周转 |
朊病毒的周转 | 突触可塑性 | |
B) 肥胖/II型糖尿病 |
胰腺β细胞增殖 | 胰岛素介导的葡萄糖摄取 | 肝葡萄糖的生成 |
脂肪生成和TG沉积 | 脂肪组织重塑 | 脂肪组织脂肪酸氧化/棕色脂肪转化 |
动脉粥样硬化、胆固醇清除和沉积 | 脂肪组织巨噬细胞增殖和活化 | 肌肉线粒体β-氧化和生物发生 |
肝脏TG的合成与释放 | | |
C) 癌症/肿瘤形成 |
肿瘤细胞增殖和死亡率 | 血管新生 | 淋巴管生成/转移扩散 |
DNA甲基化/脱甲基 | 核糖核苷酸还原酶活性 | 组蛋白去乙酰化 |
癌前进化到侵袭性表型 | 肿瘤特异性T细胞增殖 | 细胞外基质转换 |
表1:因果途径的例子
网络动力学探究
也许近年来稳定同位素生物标记最令人兴奋的进展是“网络动力学”的出现:对构成生命系统的复杂生化网络的动态行为进行全面的探究。这已经成功地应用于临床前模型和人类的全球蛋白质组动力学或动态蛋白质组学[12,13]。这提供了一种新型的系统生物学,作为生物标记物发现的无偏倚筛选工具具有巨大的潜力。
动态蛋白质组学代表了“组学”技术中功能上最可解释的技术,不仅提供热图或信息学,而且提供功能上可解释的系统生物学信息。图3显示了测量蛋白质组动态的操作流程图。该方法已成功应用于以下场景,如热量限制对细胞蛋白稳态的影响,包括线粒体生物发生和线粒体自噬;慢性淋巴细胞白血病肿瘤细胞不良预后的蛋白质组动力学特征区分成功补偿肥胖动物胰岛素抵抗的胰岛和衰竭并变得“疲惫”的胰岛;运动对肌肉蛋白质组转换的影响神经炎症对脑脊液蛋白质组周转的影响;血脂异常状态下高密度脂蛋白(HDL)蛋白质组的动态变化;以及生理学和病理生理学中的其他问题。
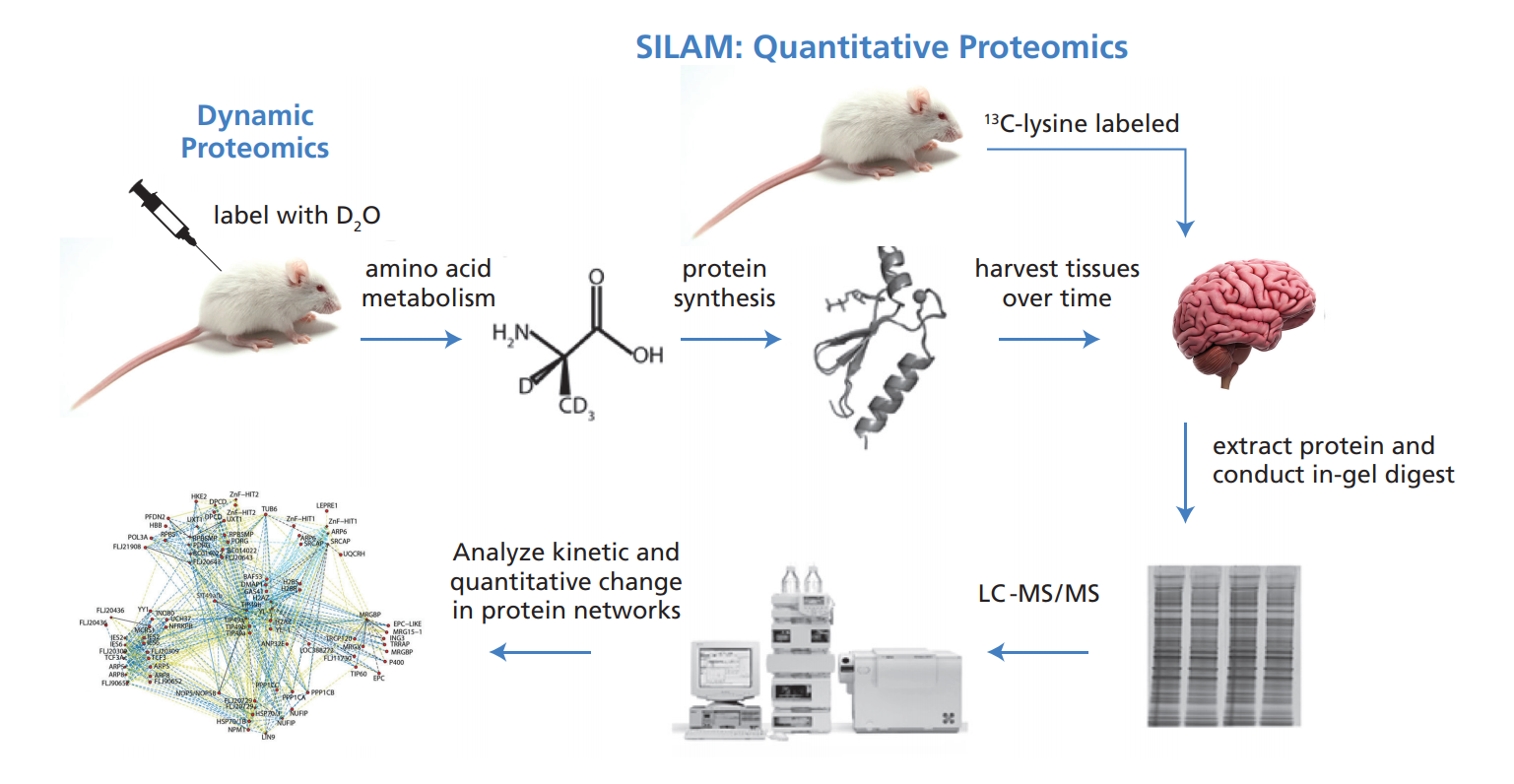
图3:动态蛋白质组学:在体内通过稳定同位素标记测量蛋白质组动力学和浓度。
用于细胞内通路非侵入性生物标记物的“虚拟活检”方法
组织中蛋白质组动力学的无偏筛选也可以导致发现可在体液中采样的靶向蛋白质生物标记物。被称为“虚拟活检”技术(图4),这是一种强大的方法,用于测量难以接近的原始组织(如骨骼肌、心脏、大脑、肾脏、肝脏或癌症组织)中蛋白质合成或蛋白质分解的速率,通过测量可接近的体液(如血液、脑脊液、唾液或尿液)。该方法包括给药稳定同位素示踪剂(例如,氧化氘(D, 70%);L-亮氨酸(13C6, 99%);甘氨酸(15N, 98%);螺旋藻全细胞(冻干粉)(U-15N, 98%),代谢并入新合成的蛋白质。然后这些蛋白质逃逸到可接触的体液中,从中分离并分析同位素含量或模式。所测量的逃逸蛋白的替换率反映了蛋白质在原始组织中的合成或分解率。因此,可以称作是对原始组织进行了“虚拟活检”。
虚拟活检方法可用于发现和验证生物标记物,用于药物发现和开发、识别个性化医疗中的疾病子集,以及患者的临床诊断和管理。这种方法已被开发并应用于基于血液的组织纤维化和骨骼肌蛋白合成测量,以及基于CSF的轴突运输和神经炎症测量[10]。一个例子是血浆肌酸激酶MM(来源于骨骼肌),用于从血液测试中测量骨骼肌蛋白合成代谢。还有许多其他的应用可以设想。
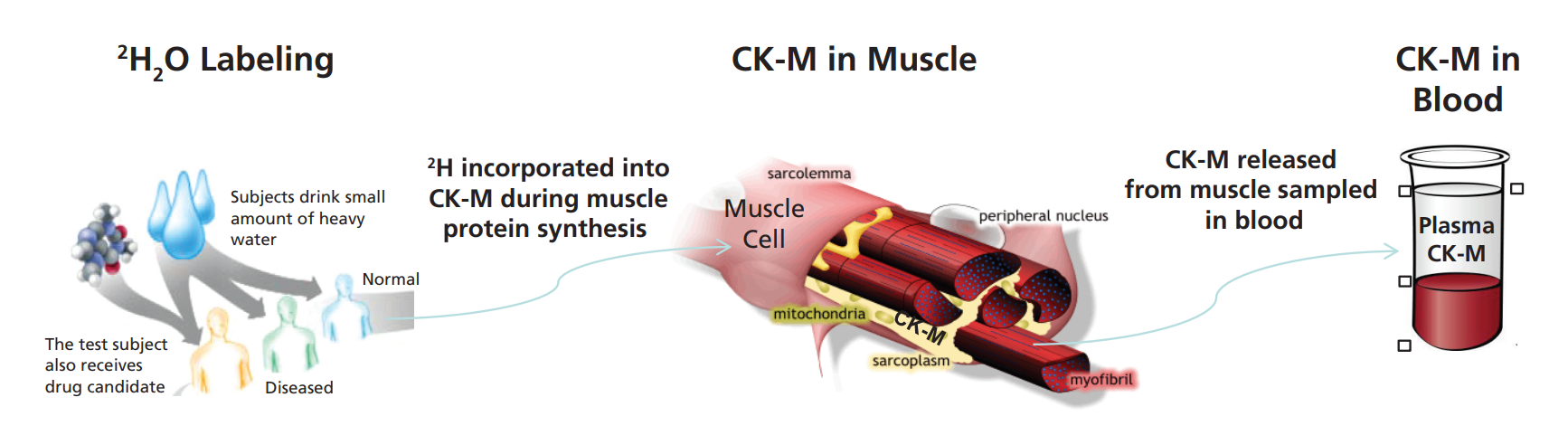
图4:动态生物标记物的“虚拟活检”技术。从血浆肌酸激酶M型(CK-M)合成骨骼肌蛋白的案例
原位动力学组织化学:结合组织病理学与稳定同位素和质谱
现在也有可能在组织病理学标本中,在空间上可视化感兴趣的目标分子的动力学[14]。将空间组织学信息与分子通量率联系起来,为病理诊断和疾病监测提供了一个显著的新维度,这可以通过激光显微解剖或物理显微切片来实现(图5)。在前列腺癌中引入稳定同位素后组织显微解剖的例子已经发表。例如,前列腺细胞的增殖梯度已被证明与前列腺癌患者活检标本的组织
学分级密切相关,并通过从精液中分离的前列腺上皮细胞的增殖率反映出来,作为一种潜在的非侵入性生物标记物[14]。
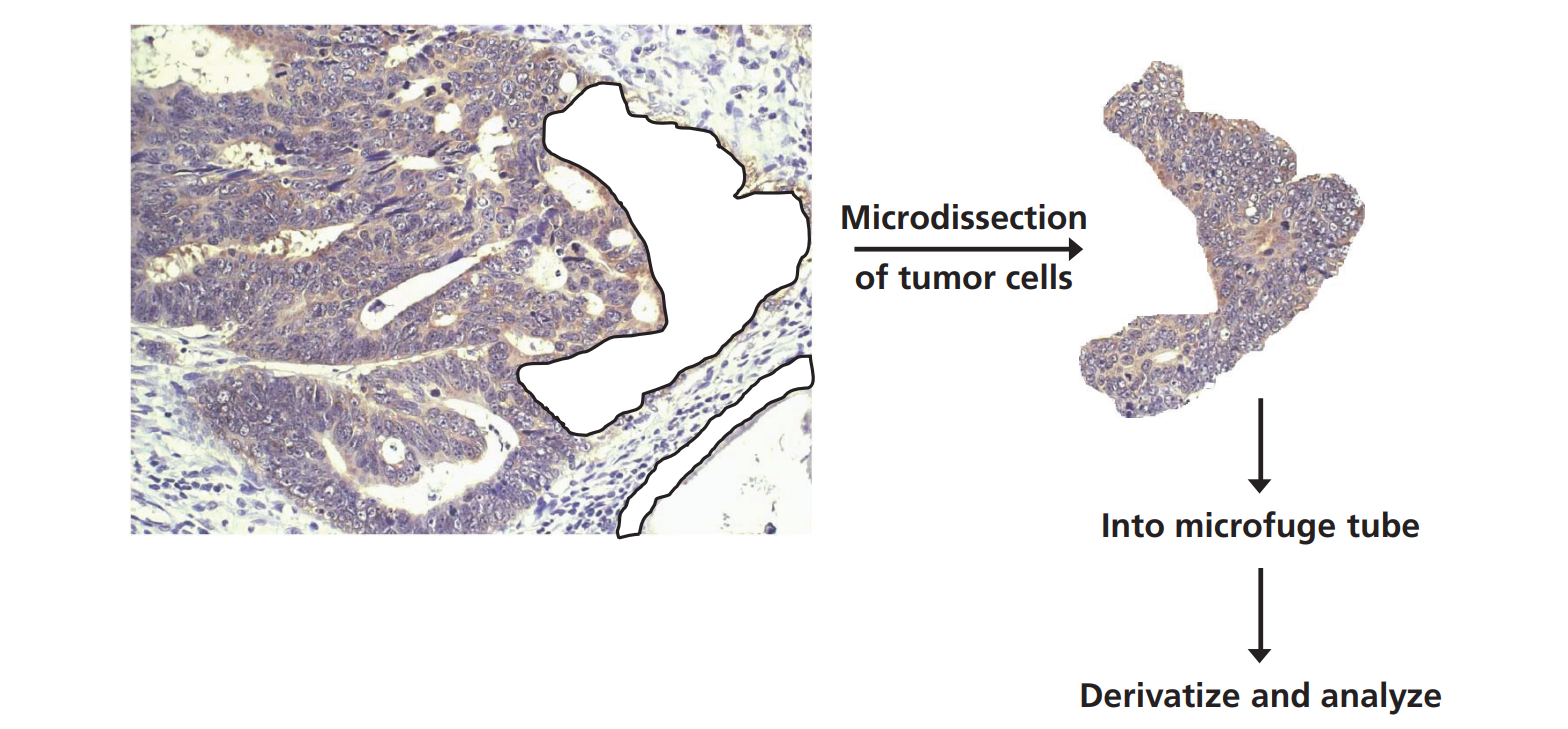
图5:用于质谱动力学分析的正常和肿瘤组织的显微解剖。
组织样本的动力学成像
通过将稳定同位素标记与组织质谱成像相结合,通过基于NIMS或MALDI的组织切片空间可视化,现在可以实现动力学或代谢通量成像。肿瘤模型中空间定义的动力学脂质组学揭示了小鼠乳腺癌模型中与体内侵袭性相关的肿瘤行为的解剖学差异[15]。
稳定同位素生物标记物在药物开发中的实际应用
基于同位素的稳定生物标记物在药物发现和开发中有许多用途(表2)。将临床前研究结果迅速转化进行人体实验;“快速杀伤”的代理或类对目标路径的活性差;确定适当的患者亚群进行治疗;确定最佳剂量、状态、测量终点和受试者间反应变异性;医疗个性化(伴随诊断);通过调整剂量来预测毒性或避免毒性。可预测疾病结果的转译标记物还允许选择最能反映人类疾病的动物模型,或者从药物开发过程中减少甚至逐渐消除动物模型。
减少推测过程: |
1. 选择目标; |
2. 选择化学类别及类别中最佳化合物; |
3. 确定合适的受试者(排除有毒性风险的无反应亚群); |
4. 为临床试验寻找最佳剂量和方案; |
5. 在患者中选择终点进行测量和预期的变异性; |
6. 给药以最大限度地减少毒性; |
7. 测试个性化调整是否能改善反应; |
8. 决定是否提前退出(快速杀伤)。 |
表2:因果路径指标的应用
基于稳定同位素的动态生物标记物与静态生物标记物相比具有优势,同时具有补充作用
传统的静态生物标记提供了有关生命系统中分子的浓度、存在或结构的信息。相比之下,动力学生物标记物揭示了通向和离开这些分子的途径的动态行为。例如,组织中胶原蛋白的数量并不能显示在疾病环境中或开始治疗干预后胶原蛋白合成(成纤维)的速度。线粒体蛋白质的含量也没有告诉我们线粒体生物发生或线粒体自噬是由干预引起的程度。同样,脑脊液中蛋白质的浓度也能告诉我们大脑神经元将这种分子通过轴突运送到神经末梢的效率。后一种过程的核心都是分子通过复杂的途径和网络流动。
这些致病过程或疾病途径的活性原则上是与疾病的发生、严重程度、进展和治疗逆转最密切相关的指标。如上所述,测量分子通量速率的唯一方法是引入同位素标签。虽然静态参数可以提供关键的补充信息,如池大小和分子组分的净增益或损失,但只能通过动力学测量来揭示潜在致病过程的功能活性。
与静态“组学”生物标记物相比,同样的考虑适用于“网络动力学”,如动态蛋白质组学,但有一个额外的点值得注意。蛋白质的合成和分解速率通常代表细胞或有机体的主动决定,在健康或疾病的背景下,这种决定在功能上是可解释的。以蛋白质为例,基于泛素蛋白组的去除,转录因子刺激的合成,细胞器生物发生过程中的组装,囊泡中的包装和分泌,通过未折叠蛋白反应的调节,作为细胞外基质的沉积,作为蛋白质信号级联的一部分的诱导等等,这些都可以被生理学家、毒理学家和临床医生从功能角度考虑。对于蛋白质的简单存在或浓度并不总是如此。由于内在功能意义和广泛、无假设筛选之间的结合,动态蛋白质组学是一种特别强大的生物标记物和靶标发现技术。
小结
总之,将基于稳定同位素的生物标记物添加到诊断库中,为药物开发带来了一个新的和迅速扩大的维度。这些生物标记物提供了关于疾病基础生物学的功能可解释的决策相关信息,捕捉了驱动疾病和治疗的因果途径的活动。因此,动力学生物标记物可预测临床应答及其与靶点接触或临床治疗方案效果的关系。稳定的基于同位素的动力学生物标记物在个性化医学的新兴时代是特别强大的补充。参考文献
1. Swann, J.P. 2011. Summary of NDA Approvals & Receipts, 1938 to the present, FDA History Office, http://www.fda.gov/AboutFDA/WhatWeDo/History.
2. Duyk, G. 2003. Attrition and translation. Science, 302(5645), 603-605.
地 址: 上海市新金桥路36号财富中心16楼
联系人: 阿博士
电 话: 400-620-6333
传 真: 021-50323701
Email:market@aladdin-e.com






