使用阵列式SPR传感器ProteOn XPR36系统进行受体功能研究
在复杂的生命活动中,蛋白质能够传递特定的信号,组合成多蛋白复合物,控制酶的活性,并调节细胞的活动。这些工作大多需要特定的蛋白与蛋白之间的相互作用来完成。现在越来越多的研究是围绕着蛋白-蛋白相互作用的机制、反应亲和力的差异以及抑制剂对蛋白复合物形成的影响等方面展开的。深入了解这些相互作用的机理或是强弱关系,对于认识生命的过程的,揭示疾病的发生发展过程,乃至对药物开发提供靶点和候选物,都有非常重要的意义[1]
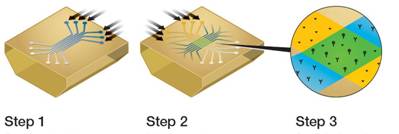
表面等离子体共振(Surface Plasmon Resonance,SPR)技术是一种快速进行体外生物分子间相互作用分析的工具,而且具有非标记、实时性和精确定量的优点。目前,利用这一技术进行生物分子相互作用分析的仪器种类很多,美国Bio-Rad公司最新推出的一款ProteOn XPR36蛋白相互作用阵列系统,就是其中的优秀代表。如下图所示,这款仪器的芯片上有36个相互作用位点,排成6×6的阵列形式,可以同时标记1-6种不同的配体分子,平行地检测6个不同分析物或分析物的6个浓度,因而可以平行分析多对相互作用[2]。这种分析方式对于当今生命科学研究非常有价值,正如美国加州大学Irvine分校的Robert Corn所说:“要进行严格意义上的蛋白质组学研究,你需要同时研究多对蛋白之间的相互作用”[3],因为多蛋白平行分析,不仅带来了效率的提高,更给出了在严格相同条件下检测的结果可靠性和重复性。
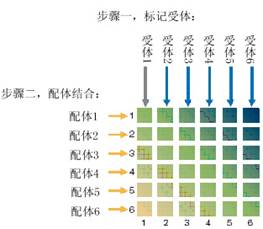
利用这种分析方法,研究者可以非常方便地进行配体和受体研究。现在受体功能的研究已经从传统的观察受体和配体的结合与否,深入到受体生物学功能的产生机理上。因此,常常需要观察天然存在的配体和不同亚型的受体之间的相互作用强弱关系,或者用突变制造一些人工配体,通过研究突变型和野生型配体与受体之间结合特性的差异,来揭示受体生物学功能的产生机制,从而为疾病的机理研究或药物发现提供理论基础。利用Bio-Rad公司ProteOn XPR36系统进行这方面研究,可以极大地简化实验步骤。只需要在芯片的不同通道上偶联不同亚型的受体,然后不同浓度的配体同时流过芯片,只需一次就可以测出配体和多个受体的亲和力。也可以不同配体同时流过不同通道,根据反应曲线即可判断不同配-受体间相互作用的快慢和大致强弱关系,如下图所示。
关于这方面的研究,以色列Weizmann研究所的研究小组给出了一个出色的例子[4],[5]。以往的研究发现,IFNa主要表现出明显的抗病毒作用,但抗肿瘤增殖的作用却比较弱,相反IFNb的抗肿瘤增殖比较强。两种干扰素都结合受体IFNAR,那么功能差异的原因是什么呢?这个小组的研究人员将IFNa受体的两个亚基固定在ProteOn XPR36系统芯片的不同通道上,分别测定这两种干扰素和受体两个亚基的亲和力,发现IFNb与其受体各亚基的亲和力明显强于IFNa。是不是亲和力强弱决定了I类干扰素的抗肿瘤作用呢?研究人员用噬菌体展示技术筛选得到了IFNa的几个突变体,这些突变体与IFN受体的亚基1(IFNAR1)亲和力强于IFNa,表现出的抗肿瘤增殖作用也强于后者,而且表现出明显的对应关系,即亲和力越强,抗增殖作用也就越明显。所以作者初步认为,抗肿瘤增殖的作用取决于干扰素与IFNAR1的亲和力。
然而进一步的研究却并不支持这一结论,很多IFNa的突变体虽然亲和力强于IFNa,但抗肿瘤增殖效果却并不相应增强。于是作者进一步分析内在的机制。SPR技术不仅可以测定两种分子间的亲和力,而且可以测定表征结合和解离速率的动力学数据—kon和koff。作者仔细测定了所有这些突变体的动力学数据后,发现配体-受体复合物越稳定(koff数值越小),配体的抗肿瘤增殖作用越明显。因此,复合物的解离动力学数据比单纯的亲和力更加重要。定量研究蛋白相互作用的亲和力和动力学,可以帮助科研人员更深入地研究蛋白功能。SPR技术是测定反应动力学和复合物亲和力的最佳手段。而Bio-Rad公司ProteOn XPR36系统能够帮助科研人员更快速方便,更准确地测定生物分子间的相互作用数据。
[1] Chen Katz,et al.; Molecular basis of the interaction between the antiapoptotic Bcl-2 family proteins and the proapoptotic protein ASPP2. Proc Natl Acad Sci., 2008, vol. 105, no. 34, 12277–12282.
[2] Rich RL and Myszka DG, Higher-throughput, label-free, real-time molecular interaction analysis, Anal Biochem 361, 1–6 (2007)
[3] Nathan Blow. Proteins and proteomics: life on the surface. 389-393, nature methods, vol.6 No.5, May 2009.
[4] Kalie E et al., An Interferon alpha2 Mutant Optimized by Phage Display for IFNAR1 Binding Confers Specifically Enhanced Antitumor Activities, J Biol Chem. 2007 Apr 13;282(15):11602-11
[5] Eyal Kalie, et al.; The Stability of the Ternary Interferon-Receptor Complex Rather than the Affinity to the Individual Subunits Dictates Differential Biological Activities; JBC., Nov 2008; 283: 32925 – 32936.
