
期刊:Science Translational Medicine
影响因子:15.8
主要技术:ScRNA-seq;足月分娩;信号传导
导语
分娩是一个复杂的生理过程,需要母体和胎儿多种信号通路的精心协调。然而,在分娩过程中促进母胎串扰的细胞贡献和通讯尚未完全阐明。本研究采用单细胞RNA测序(scRNA-seq)技术来破译足月分娩过程中人类胎盘中的母胎信号。首先,建立了人类胎盘的单细胞图谱,证明母体和胎儿细胞类型在分娩过程中发生了转录组活性的变化。受分娩影响最大的细胞类型是绒毛膜(CAM)中的胎儿间质细胞和母体蜕膜细胞以及胎盘中的母体和胎儿髓细胞。细胞-细胞相互作用分析显示,CAM和胎盘细胞类型参与分娩驱动的母体和胎儿信号传导,包括胶原蛋白、C-X-C基序配体(CXCL)、肿瘤坏死因子(TNF)、凝集素和IL-6途径。将scRNA-seq数据与可公开获得的大量转录组学数据相结合,表明胎盘来源的scRNA-seq特征可以在整个妊娠和分娩过程中监测母体循环。此外,比较分析显示,足月分娩时胎盘来源的特征与自然早产和分娩时的特征相一致。此外,我们证明,在妊娠早期,分娩特异性胎盘来源的特征可以在注定要经历自发性早产的妇女的循环中检测到,无论是完整的还是过早破裂的膜。总的来说,该研究结果为人类分娩的母胎串扰提供了见解,并表明胎盘来源的单细胞特征可以帮助开发用于预测早产的非侵入性生物标志物。
主要技术
scRNA-seq;足月分娩;信号传导
研究结果
1. 人类胎盘单细胞图谱的建立
为了探索分娩过程中母体和胎儿之间的细胞相互作用,首先使用自然分娩(n = 24)和非自然分娩(n = 18)足月妇女的胎盘和胎盘外组织建立了一个全面的人类胎盘单细胞图谱。胎盘在分娩后立即收获:绒毛膜-羊膜(CAM,包括羊膜、绒毛膜和顶蜕膜)的样本,以及包括基底膜(基底蜕膜)和胎盘绒毛(BPPV)的活检(图1A)。收集的CAM和BPPV用于制备单细胞悬液,然后进行单细胞RNA测序(scRNA-seq),并在单细胞分析期间进行母体和胎儿基因分型以确定细胞类型来源(图1A)。无监督聚类分析和细胞类型注释鉴定出33个不同的簇,对应于CAM和BPPV的免疫和非免疫细胞类型(图1B和C)。非免疫细胞包括基质细胞(C7)、蜕细胞(C3)、合胞滋养细胞(STB)、细胞滋养细胞(CTB, C4)、胞外滋养细胞(EVT,C2)、非增殖性间质细胞滋养细胞(npiCTB)、EVT轨迹内的CTB亚群(CTB/EVT)、内皮细胞和子宫内膜细胞(图2)。鉴定出的免疫细胞类型有单核细胞、巨噬细胞(C4)、先天淋巴样细胞(ILCs)、淋巴内皮细胞(LED)细胞、NK细胞、T细胞(C3)和B细胞(图1B和C)。每个细胞簇的细胞计数显示了组织间细胞类型组成的差异,与BPPV相比,CAM中内皮细胞(C14和23)、基质细胞(C0、2、8、15和22)和个体细胞类型(C10、12和17)更为丰富。淋巴样细胞组成在不同细胞间无明显差异(图1B和C)。相比之下,髓系细胞在BPPV中更占优势(图1B和C)。基质-4和基质-6(C20和27)主要存在于BPPV中(图1B和C)。正如预期的那样,除了EVT-1(C1)外,BPPV中多种滋养细胞类型更为明显,EVT-1在CAM中更为丰富(图1B、C)。
在确定CAM和BPPV细胞组成的变化后,我们随后使用基因分型信息来确定所有鉴定细胞的母体和/或胎儿来源(图1D和E)。CAM和BPPV中的滋养细胞来自胎儿(图1D和E), CAM中的大部分基质细胞也来自胎儿(图1D)。如预期的那样,蜕细胞来自母体,而内皮细胞、淋巴细胞和髓细胞类型在CAM和BPPV中显示混合的母体和胎儿来源(图1D和E)。总之,这些数据提供了分娩时人类胎盘的全面单细胞景观,表明在CAM中受影响最大的细胞类型是胎儿间质细胞,而在BPPV中受影响最大的是CTB和胎儿巨噬细胞。
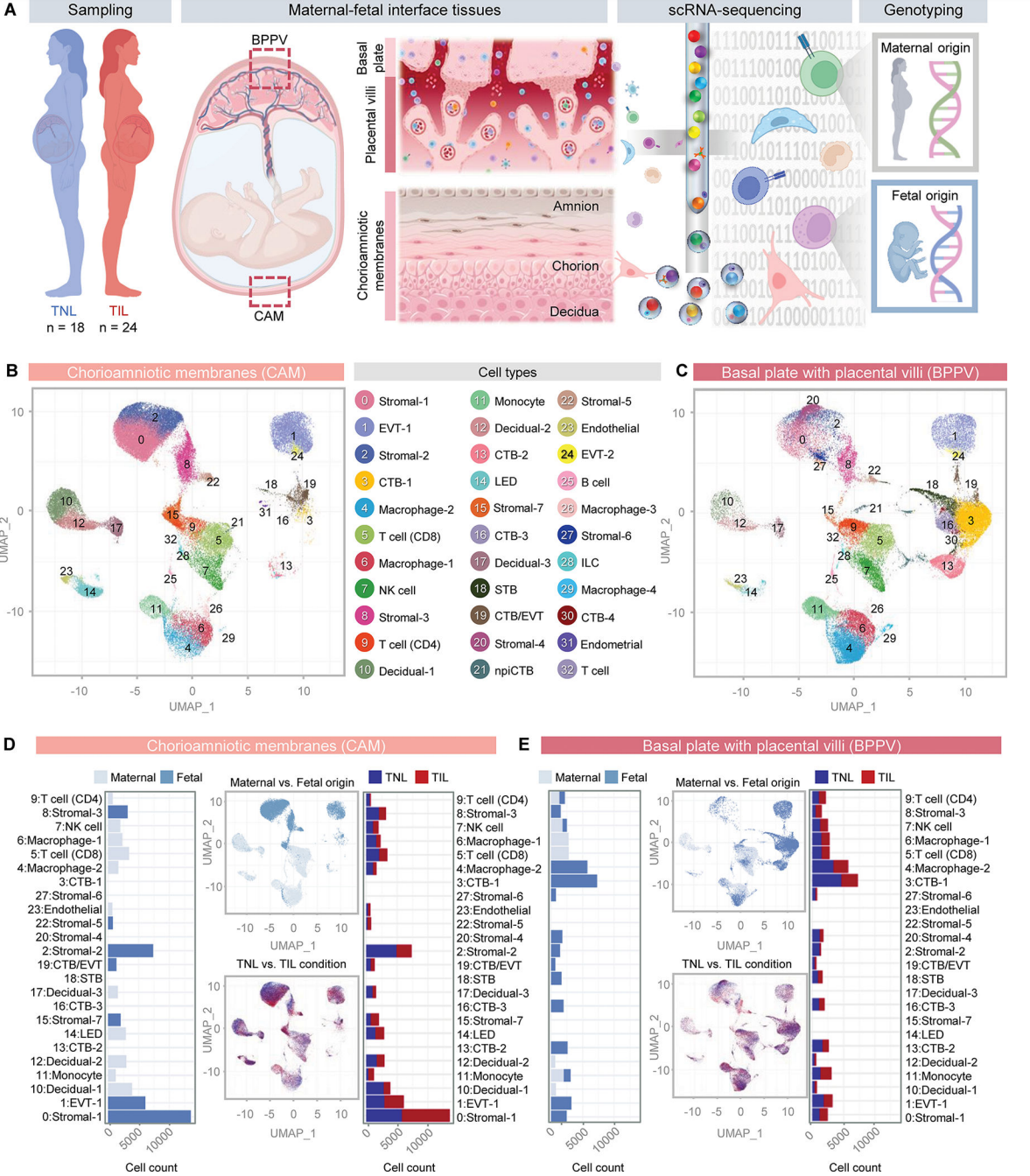
图 1
2. 母体和胎儿细胞类型显示运动驱动的转录组活性
接下来,我们探索了CAM和BPPV中由运动驱动的细胞类型特异性转录组变化(图2A)。在CAM中,胎儿Stromal-1、Stromal-2和Stromal-3表现出最大的运动驱动差异基因表达变化(图2A)。母体蜕膜-1细胞也显示出相当数量的差异表达基因(DEGs);然而,与胎儿间质细胞相比,这种变化是温和的(图2A)。在BPPV细胞类型中,DEGs数量最多的主要是母体单核细胞类型,其次是胎儿巨噬细胞-2,可能分别对应浸润性炎症单核细胞和Hofbauer细胞(图2A)。分位数-分位数图显示了CAM和BPPV中受胎儿和母体影响最大的细胞类型(图2B),这与表现出最大差异基因表达的细胞类型基本一致。值得注意的是,在CAM中发现胎儿间质细胞类型受到分娩的影响,母体蜕细胞也是如此(图2B)。同样,母体单核细胞和胎儿巨噬细胞-2在BPPV中受分娩影响最大(图2B)。分娩对细胞类型间基因表达影响的相关性分析表明,母体骨髓细胞、蜕膜细胞和胎儿间质细胞等存在相似之处(图2C)。胎儿基质亚群中,基质-1表达凋亡信号,基质-2表达ATP代谢,基质-3表达炎症反应,包括细胞因子的产生(图2D),表明这些胎儿基质亚群在分娩过程中具有不同的功能。此外,母体decidual -1显示了与细胞运动和迁移相关的过程的富集(图2D),这表明decidual细胞参与了分娩过程中的白细胞浸润。
这些数据为产妇和胎儿细胞类型的分娩特异性转录组活性提供了进一步的见解,特别是那些基因表达发生实质性变化的细胞,如CAM中的结构细胞和BPPV中的免疫细胞。此外,我们证明了在分娩过程中,细胞迁移和增殖、白细胞募集和细胞因子/趋化因子信号通路的细胞类型特异性富集。最具代表性的细胞类型,如滋养细胞,在劳动过程中没有经历基因表达的剧烈变化,这表明更多的转录活跃亚群,而不是更丰富的亚群,是劳动相关信号的主要贡献者。
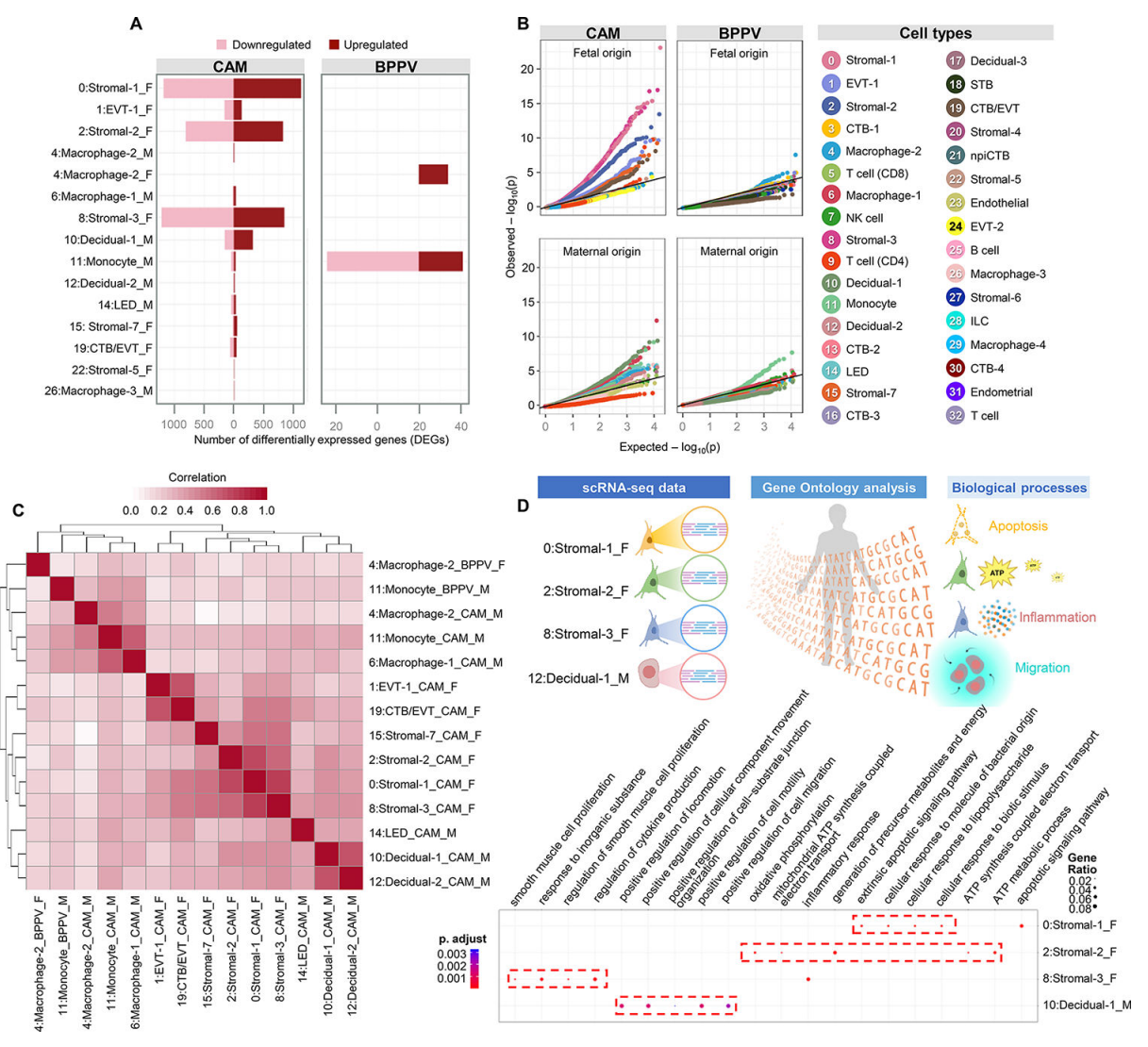
图 2
3. 分娩过程包括由母体-胎儿细胞-细胞串扰协调的炎症通路
在确定了受分娩影响最大的母胎细胞类型后,我们试图使用cellchat推断CAM中母胎串扰的最终变化(图3)和BPPV(图4)。我们首先可视化CAM细胞类型的传入和传出相互作用,其中每个箭头的方向和长度分别表示传入或传出相互作用的运动驱动优势及其强度,如相应的图例所示(图3A)。胎儿间质细胞类型在输入和输出的相互作用中都表现出最强的增加(用箭头的长度表示),暗示这些细胞是CAM中运动相关信号传导的关键参与者(图3A)。相比之下,母体T细胞、NK细胞和蜕细胞的相互作用减弱(图3A)。这种相互作用强度分析提供了关于哪些细胞在劳动过程中发生了输出和/或输入信号的变化的信息,但没有告诉我们这些信号的细胞靶点或来源。因此,我们接下来将每种细胞类型视为信号发送者或接收者,并评估细胞类型对之间的相互作用强度,如图热图所示(图3B和图3C)。胎儿基质细胞类型表现出与分娩相关的强相互作用,以及作为发送者或接受者的非免疫细胞和免疫细胞(图3B和C)。此外,多种基质细胞类型表现出自我信号传导,表明与分娩有关的正反馈循环(图3C)。与箭头图一致,母体CD4 T细胞的传入信号随着分娩而减弱(图3B)。考虑到CAM中分娩特异性细胞-细胞信号的实质性变化,我们随后选择了受分娩影响的特定信号通路,以推断出最重要的细胞类型(图3D-F),这可能表明他们参与了与分娩相关的CAM结构变化。C-X-C基序配体(CXCL)信号通路主要由母体蜕膜-3、巨噬细胞-2和巨噬细胞-1细胞类型驱动,许多相互作用指向胎儿EVT-1亚群以及其他胎儿和母体细胞类型(图3E),表明母体蜕膜细胞和胎儿滋养细胞之间存在母胎串扰。母体单核细胞和巨噬细胞-1类型驱动TNF信号传导,可能导致分娩相关炎症(图3F)。
在BPPV中,在胎儿基质细胞类型中再次观察到细胞-细胞相互作用中最强的运动相关变化,基质-1/基质-3主要表现出增加的入射相互作用强度,基质-2/基质-4主要表现出增加的外向相互作用强度(图4A)。相比之下,胎儿CD4 T细胞、巨噬细胞-2和CTB-3亚群与分娩的相互作用强度下降(图4A);这些结果反映在热图中,胎儿基质-2亚群显示出与免疫细胞作为受体的外向相互作用强度增加(图4B),这主要与炎症反应有关。
与箭头图一致,网络图表明胎儿间质细胞类型表现出更强的传入或传出相互作用(图4C)。受分娩影响的top细胞-细胞信号通路包括凝集素、TNF、IL-6、CCL、CD45、II型干扰素(IFN-II)和补体,用网络图表示(图4D-F)。凝集素通路的一个关键参与者是母体巨噬细胞-1,它与母体和胎儿单核细胞以及母体T细胞相互作用(图4D)。相比之下,BPPV中TNF和IL-6信号的主要贡献者分别是胎儿巨噬细胞-2和基质-3(图4E和F),进一步表明胎儿对分娩相关的细胞-细胞相互作用有很强的贡献。综上所述,这些细胞相互作用分析表明,分娩的特点是母体-胎儿信号通路,涉及免疫和非免疫细胞类型之间的细胞-细胞串扰。
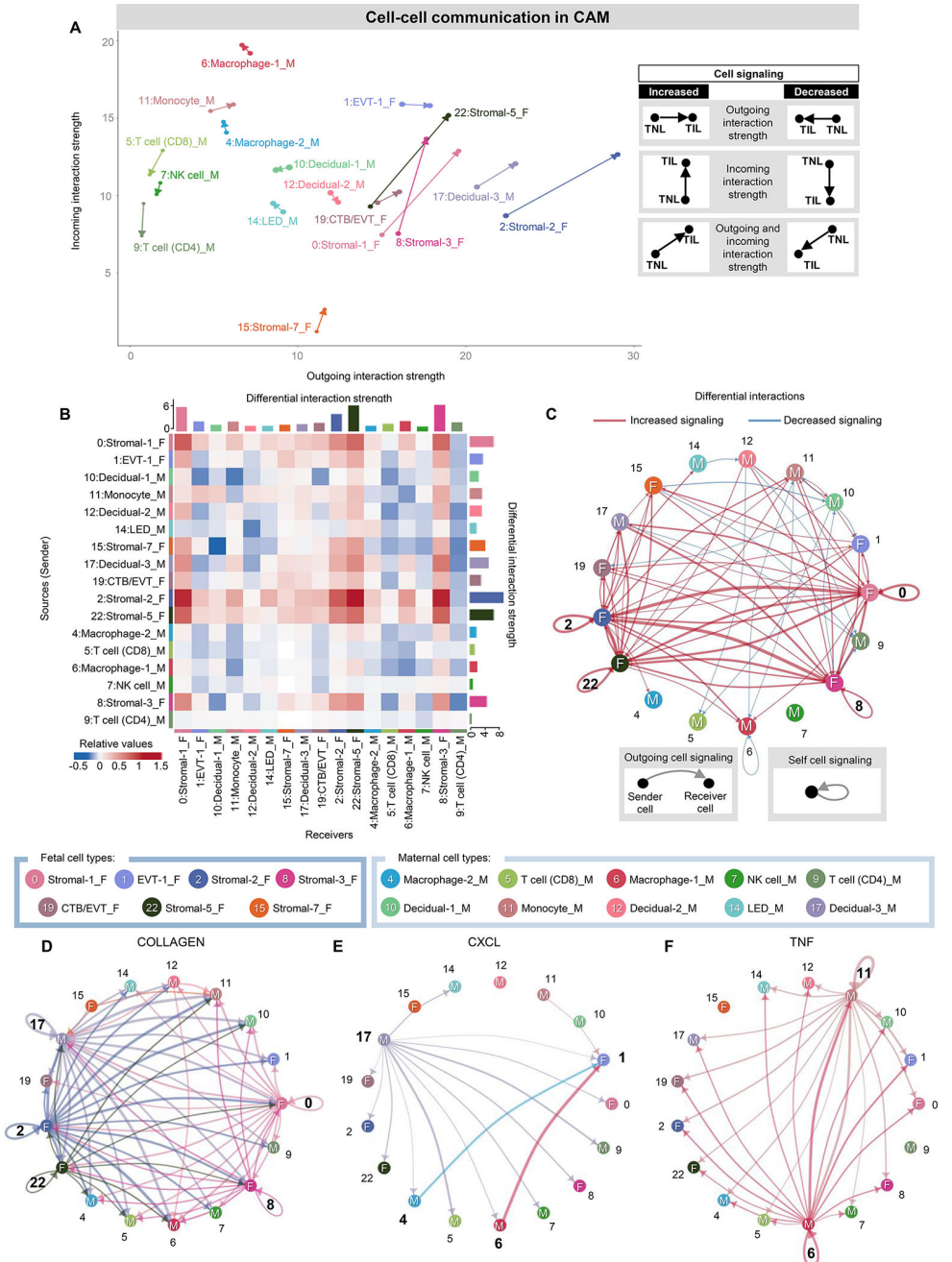
图 3
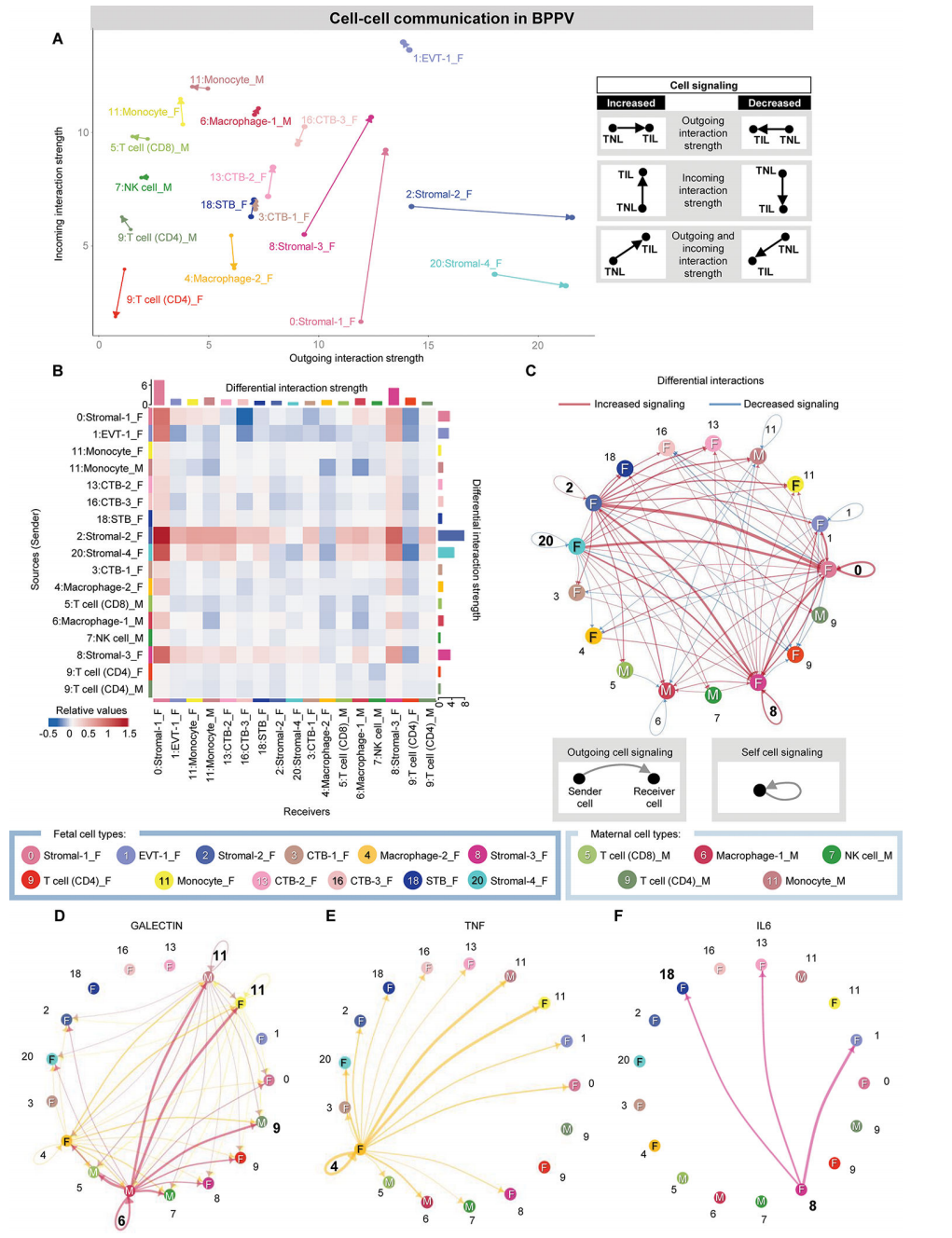
图 4
4. 来自胎盘组织的单细胞母体和胎儿特征可以在整个妊娠和分娩期间在母体循环中被监测
接下来,我们评估了细胞类型特异性转录组活性是否可以在整个妊娠期间跟踪母体循环。我们首先利用先前生成的孕妇外周血(白细胞)的大量转录组数据集(n = 49)收集整个妊娠期,并评估细胞类型特异性转录物的轨迹(图5A)。多种细胞类型特征随胎龄变化而变化;即巨噬细胞-1、巨噬细胞-2、巨噬细胞-3、巨噬细胞-4、CD4 T细胞、CD8 T细胞、B细胞、基质-2、基质-3、基质-4、基质-5、基质-7、蜕膜-1、内皮细胞、LED、npiCTB、EVT-2和STB(图5B)。观察到的变化模式在特定细胞类型的单个集群之间不一致;例如,巨噬细胞-1随着胎龄稳步增加,巨噬细胞-2和巨噬细胞-3则随着胎龄稳步增加。巨噬细胞-4呈抛物线轨迹(图5B),提示每种细胞类型簇的不同作用。考虑到细胞类型特征可以在母体外周血中追踪,我们随后评估了在同一组患者中进行纵向分析的足月分娩妇女(n = 21)和足月分娩妇女(n = 28)足月收集的样本之间的差异(图6A)。为了比较这些数据集,使用CAM 衍生的DEG来创建一个伪体数据集,该数据集可以直接与大量转录组数据集进行对比,同时仍然考虑每种细胞类型的母源或胎儿来源(图6A)。CAM与母体外周血细胞类型特异性转录本的相关性表明,胎儿基质-2以及母体巨噬细胞-1、巨噬细胞-2、蜕膜细胞-1和单核细胞呈正相关(图6B)。相比之下,几种细胞类型特征显示CAM与母体外周血呈负相关:胎儿EVT-2、母体CD8 T细胞和母体内皮细胞(图6B)。当使用来自BPPV的细胞类型特征时,我们注意到该组织与母体外周血之间的额外相关性(图6C)。胎儿EVT-1、CTB-1、巨噬细胞-2、CD4 T细胞、CTB-3、STB和npiCTB在室间都显示出正相关,母体巨噬细胞-1、巨噬细胞-2、单核细胞和蜕膜细胞-2也是如此(图6C)。胎儿基质-1以及胎儿和母体NK细胞的特征在BPPV和母体外周血之间呈负相关(图6C)。这一比较分析支持了胎盘细胞进入母体循环和/或分娩相关信号驱动外周白细胞转录组变化的概念,这些外周白细胞的转录组变化至少部分与胎盘组织中的转录组变化相同。我们的数据进一步表明,可以无创地跟踪母胎信号,以监测正常妊娠和分娩,并可能用于生成产科疾病的生物标志物。
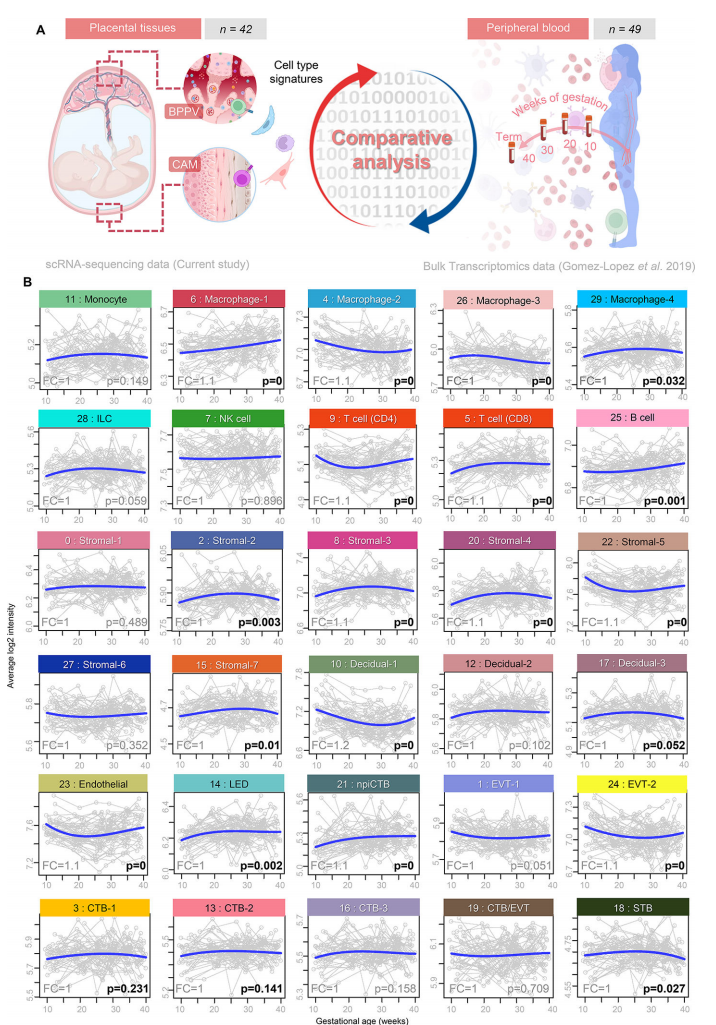
图 5
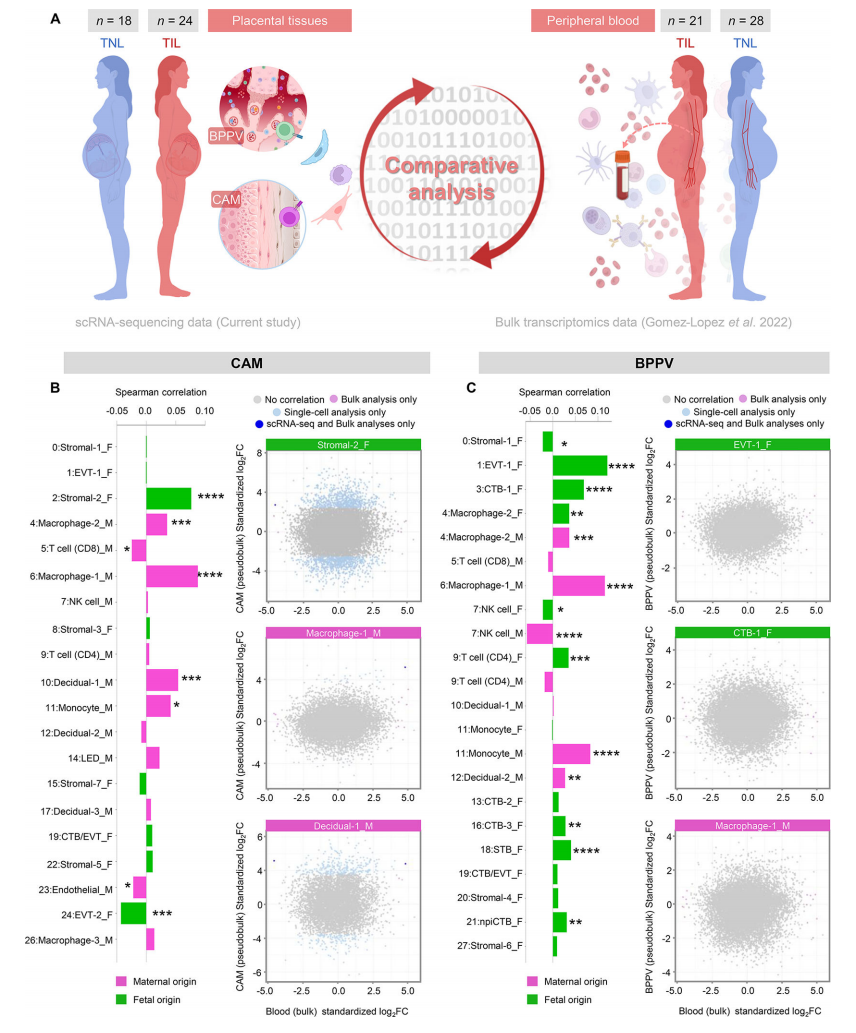
图 6
6. 足月分娩相关的母胎单细胞特征在CAM中部分与自然早产妇女的特征重叠
我们的研究结果表明,随着分娩,CAM的转录组活性似乎经历了更剧烈的细胞类型特异性变化(图2A),这与这些组织参与分娩的共同途径是一致的。虽然被认为是一种不同于足月分娩的病理过程,但自发性早产也包括激活常见的分娩途径。因此,我们下一步评估是否在自发性早产和分娩的妇女组织中也观察到与产程相关的CAM基因表达变化(产程与PTL)。为此,我们利用了以前CAM的大量转录组数据集。来自经羊膜穿刺术诊断羊膜腔炎症和微生物状态不同的早产和自发性早产妇女:无羊膜内炎症[低浓度IL-6 (<2.6 ng/mL),通过培养和分子微生物方法检测不到微生物](PTL, n = 12);无菌羊膜内炎症[IL-6浓度升高(≥2.6 ng/mL),未检出微生物](PTL+SIAI, n = 17);或羊膜内感染(IL-6浓度升高,可检测微生物)(PTL+IAI, n = 11)(85-92)(图7A)。为了获得细胞类型特异性PTL相关的变化,将各组CAM的大量转录组谱与对照组[经历过自发性早产但足月分娩的妇女(n = 15)]进行比较(图7A)。在CAM中,产期相关特征与胎儿Stromal-1、Stromal-3、Stromal-5、Stromal-7、EVT-1和CTB/EVT的PTL特征呈正相关(图7B)。母体蜕细胞类型和巨噬细胞对应的特征在产程和PTL之间也观察到适度的正相关。足月产程与PTL+SIAI呈正相关;即EVT-1、CTB/EVT和基质细胞类型,而其余的仅显示轻微或最小的正相关(图7B)。因此,我们的研究结果表明,在足月分娩的生理过程中,CAM中的母胎信号与自发性早产时观察到的信号重叠;然而,羊膜腔的炎症和微生物状态驱动母胎细胞类型的特异性转录组活性。
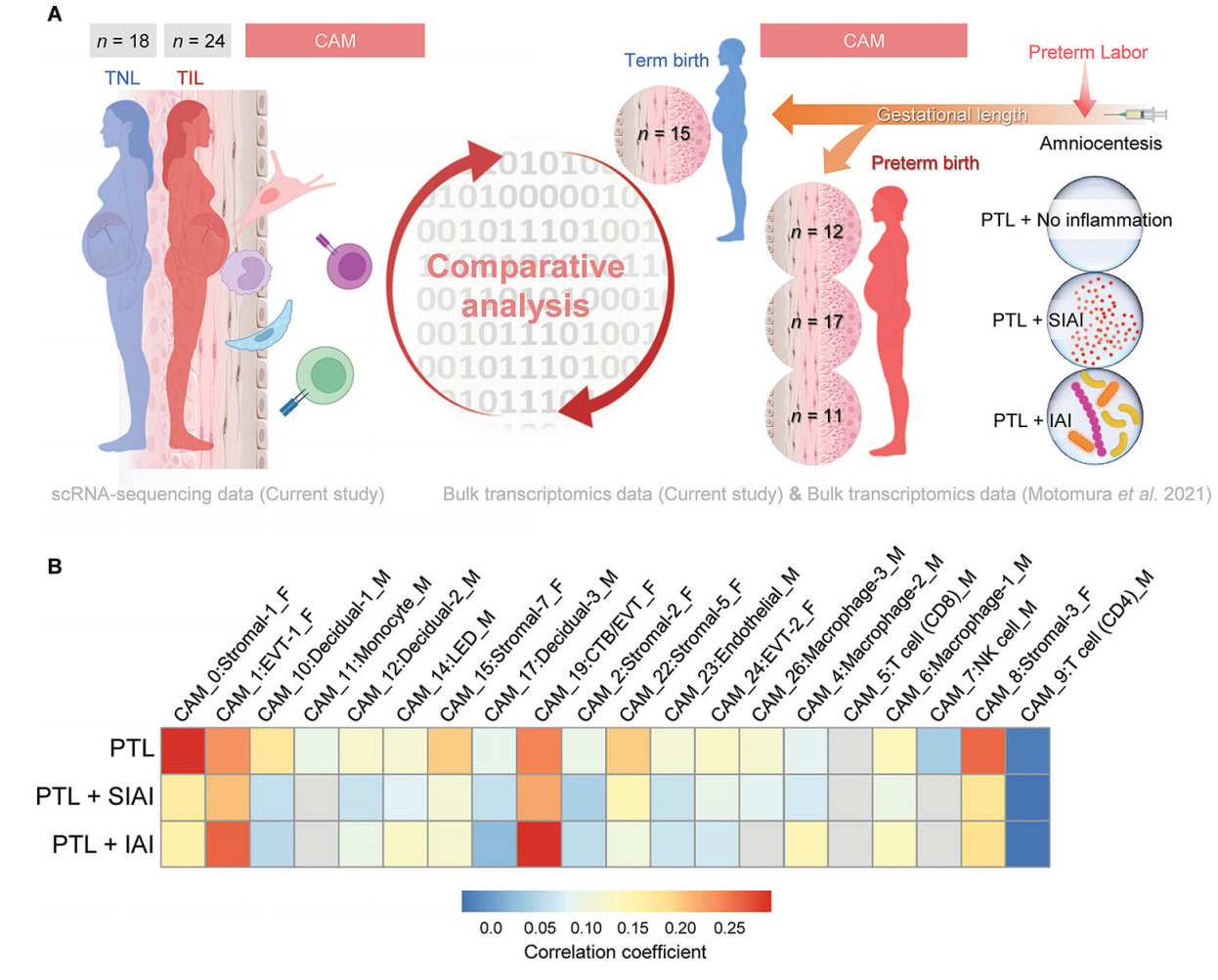
图 7
7. 分娩相关的单细胞CAM衍生的特征可以作为非侵入性生物标志物来识别要经历自发性早产的妇女
我们最后试图确定在最终发生早产的妇女的外周血中,是否可以在妊娠中期和晚期追踪分娩特异性CAM衍生的scRNA-seq特征,这可能会为即将发生的早产产生预测性生物标志物。首先,我们使用了之前从横断面研究中生成的大量转录组数据集,包括来自以下人群的外周血样本:1)经历过自发性早产和早产的妇女(病例);2)足月分娩的胎龄匹配的对照组。大量转录组的主成分分析显示,病例(红点)与对照组(蓝点)有一定程度的分离,这似乎是由PC2驱动的。然后,我们将分娩特异性CAM衍生的scRNA-seq特征与母体血液转录组叠加,并评估每种细胞类型对PC1和PC2的贡献和相关性。所有细胞类型均参与PC1;单核细胞、LED和基质细胞类型与PC2呈正相关,而NK细胞、CD8 T细胞和巨噬细胞-3与PC2呈负相关。通过建立个体单细胞特征的受试者工作特征(ROC)曲线,我们发现其中一些(如母体蜕膜-2)对于识别最终发生早产的早产妇女具有价值。
接下来,我们试图利用我们的分娩特异性CAM衍生的scRNA-seq特征在妊娠中期和晚期(在早产发作的临床表现之前)收集的母亲血液样本中预测两种不同的自发性早产亚群(自发性胎膜完整早产(sPTL)和早产胎膜破裂(PPROM))。我们利用了先前从一项前瞻性大量转录组学研究中生成的数据集,包括两个外部验证队列,这些数据来自妊娠17至33周最终接受sPTL或PPROM的妇女的外周血(图8A)。通过比较从最终经历早产的妇女和胎龄匹配的足月分娩的对照者收集的血液样本之间的基因表达谱,获得了sPTL和PPROM相关的转录组活性。这种与sPTL和PPROM相关的转录组活性随后与本研究中产生的运动特异性CAM衍生的scRNA-seq特征相关(图8A)。在最终接受sPTL或PPROM的妇女的血液循环中,强烈检测到几种分娩特异性CAM衍生的scRNA-seq特征(图8B)。母体和胎儿来源的多个分娩特异性CAM衍生的scRNA-seq特征-最突出的是母体蜕膜细胞-1和胎儿基质细胞类型-与PPROM相关的转录组活性显示出很强的正相关(>0.10相关系数),相关强度根据采样时间点而变化(图8B)。母体巨噬细胞类型与胎儿其他非免疫细胞类型也观察到中度正相关(>0.05)(图8B)。足月分娩和sPTL相关转录组活性之间的相关性强度低于PPROM;然而,母体蜕膜细胞-1和胎儿基质细胞类型也是主要的贡献者(图8B)。来自母体巨噬细胞-2和胎儿EVT-1的实验室特异性CAM衍生的scRNA-seq特征与PPROM和sPTL相关的转录组活性呈负相关。
然后,我们为每个验证队列生成ROC曲线,并根据采样时的胎龄来确定这些特征对sPTL或PPROM的预测程度。对于即将发生的sPTL的预测,与队列2相比,使用队列1的样本时,母体Decidual-1特征显示出更大的价值,与这些患者是否在17 - 23岁时采样无关[队列1:AUC为0.648 (0.503-0.794)vs队列2:AUC 0.536(0.389-0.683)或27 - 33[队列1:AUC 0.602 (0.454-0.750) vs;队列2:AUC 0.497(0.321-0.674)]妊娠周(图8C)。相比之下,对于PPROM,队列2在妊娠17 - 23周[队列2:AUC 0.612 (0.493-0.731) vs队列1:AUC 0.564(0.429-0.699)]和27 - 33周[队列2:AUC 0.654 (0.533-0.775) vs队列1:AUC 0.610(0.476-0.745)]时的母体Decidual-1特征的预测值略有提高(图8C)。队列之间表现的差异可能是由于纳入的人群不同(队列1来自美国密歇根州的底特律,队列2来自加拿大阿尔伯塔省的卡尔加里)。母体decual -1特征对PPROM的预测价值在孕晚期略有增加[队列1,27 - 33周:AUC 0.610 (0.476-0.745) vs队列1,17 - 23周:AUC 0.564 (0.429-0.699);队列2,27 - 33周:AUC 0.654 (0.533-0.775) vs队列2,17 Ga- 23周:AUC 0.612(0.493-0.731)],表明采样和结果预测之间的时间缩短。胎儿基质-1信号对sPTL的预测比对PPROM的预测更明显;然而,与27 - 33周的sPTL相比,其预测性能在17 - 23周有所改善[队列1,17 - 23周:AUC 0.623 (0.483-0.764) vs队列1,27 - 33周:AUC 0.559 (0.416-0.703);队列2,17 - 23周:AUC 0.559 (0.408-0.710) vs队列2,27 - 33周:AUC 0.518(0.324-0.711)(图8D)。对于PPROM,队列2的胎儿基质-1特征的预测性能在两个采样时间都得到了改善[队列2,17 - 23周:AUC 0.665(0.561-0.769)与队列1,17 - 23周:AUC 0.579 (0.445-0.712);队列2,27 - 33周:AUC 0.633 (0.518-0.748) vs队列1,27 - 33周:AUC 0.618(0.489-0.747)(图8D)。这一概念验证分析表明,在母体循环中追踪相关的单细胞特征可能提供一种预测即将发生的sPTL或PPROM的方法。
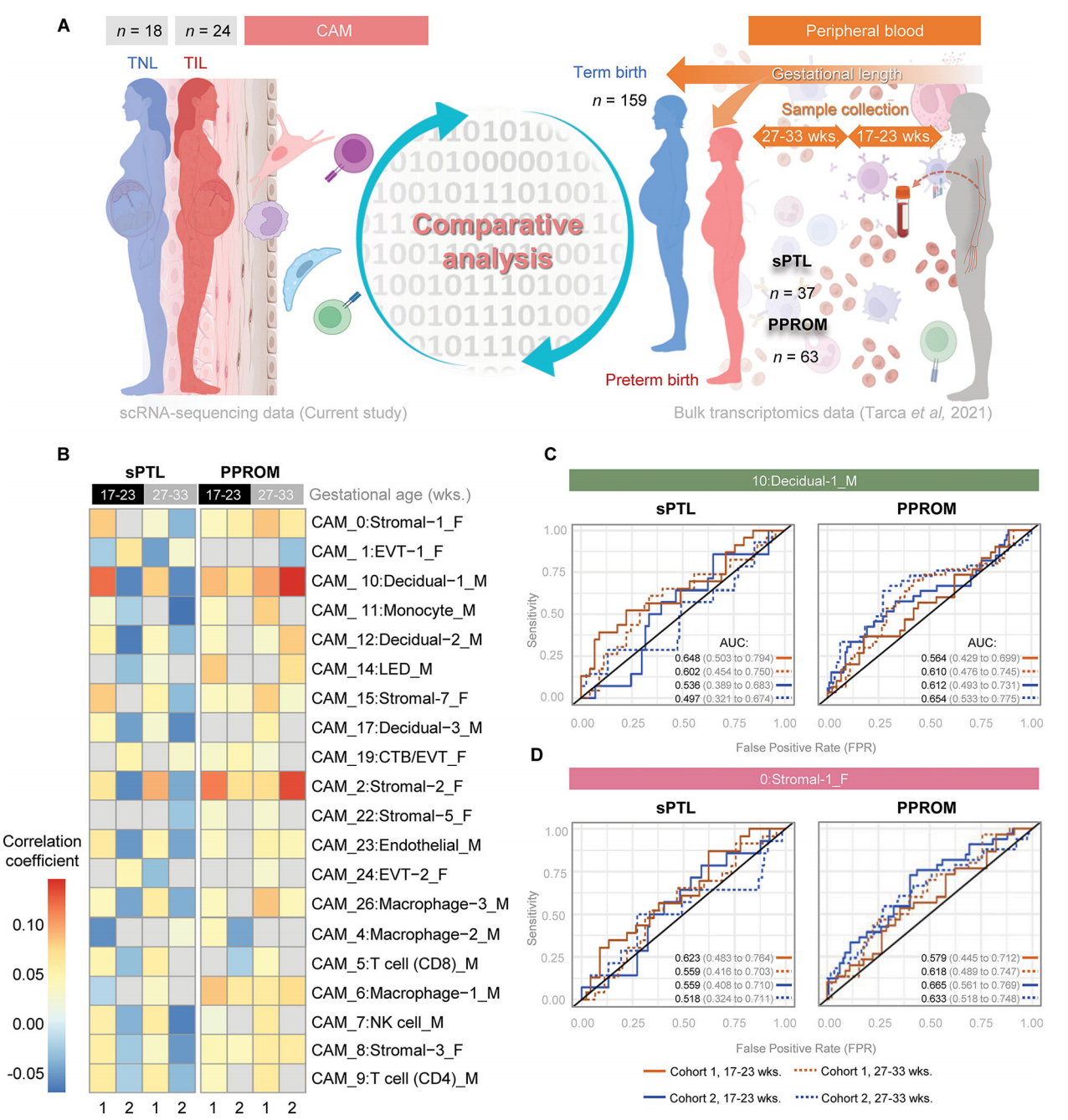
图 8
结论
在这里,我们应用scRNA-seq技术发现,基底膜、胎盘绒毛和绒毛膜羊膜包括母体和胎儿起源的免疫和非免疫细胞类型,但细胞组成不同。先前对胎盘组织的单细胞调查提供了妊娠早期、妊娠中期和妊娠晚期的细胞组成概述,并允许鉴定先前未描述的细胞类型。我们的数据进一步强调了胎盘和胎盘外(绒毛膜和羊膜)组织之间的细胞类型组成和相对丰度的差异,这是由它们不同的功能驱动的。事实上,对妊娠中期绒毛(胎盘)绒毛膜和平滑(胎盘外)绒毛膜的比较分析表明,特定细胞类型(如基质细胞)的丰度不同,以及相似细胞簇之间空间依赖性功能差异。
在怀孕不同时期的单细胞探索清楚地表明,这些隔室的细胞组成不是静态的,而是在整个怀孕期间经历动态变化。在这里,我们发现,与胎盘组织相比,绒毛膜羊膜显示出更多受分娩高度调节的细胞类型,这与膜激活作为分娩共同途径的重要组成部分的参与是一致的。绒毛膜羊膜中受分娩影响最显著的细胞群是胎儿间质细胞、母体蜕膜细胞和母体巨噬细胞。研究了蜕细胞和母体巨噬细胞在分娩过程中的参与;然而,胎儿间质细胞在分娩中的作用尚未得到很好的证实。数据而本项目表明胎儿间质细胞在分娩过程中具有高度活跃的作用,值得进一步研究。此外,我们报道了胎盘组织中受分娩影响最大的细胞类型是胎儿巨噬细胞和母体单核细胞。目前的证据表明,这些细胞主要表现为m2样表型,与母体细胞相似,这暗示了它们在正常妊娠中的稳态作用。分娩过程中胎儿巨噬细胞参与炎症信号通路可能表明,这些细胞在分娩过程中经历了向促炎表型的转变,这是正常分娩过程的一部分,正如母体蜕膜中存在的巨噬细胞所证明的那样。胎盘组织中检测到的母体单核细胞群可能代表存在于绒毛间隙的循环细胞。
胎盘组织脱落细胞外囊泡、颗粒和其他碎片进入母体循环。由于这种脱落,母体循环已被证明是具有诊断潜力的无细胞DNA和RNA的来源,并且母体外周血中的标记物可用于监测妊娠和分娩。在这里,我们利用这一概念来监测和潜在的预测病理性分娩(如早产)。在没有羊膜内炎症的情况下,足月分娩和早产之间的正相关性涉及广泛的细胞类型。没有羊膜内炎症的早产通常被认为是特发性的,因此这个研究组可能包括多种潜在的机制。事实上,我们之前的工作已经暗示巨噬细胞激活是特发性早产和出生的潜在免疫机制。相比之下,早产合并羊膜内炎症的病例似乎涉及相似的细胞类型,无论无菌或微生物性质。基质细胞和巨噬细胞都是已知的宿主对病原体反应的参与者。母体巨噬细胞的正相关性可能反映了急性组织学绒毛膜羊膜炎的存在,这是一种胎盘病变,是由于微生物侵入羊膜腔时,先天免疫细胞浸润到绒毛膜羊膜引起的。这些结果表明,生理性分娩妇女的CAM转录组学变化与自然早产妇女的CAM转录组学变化重叠;然而,如前所述,羊膜腔的炎症和微生物状态也会驱动胎盘转录组活性。
本文包括的自发性早产的两个亚群,sPTL和PPROM,涉及不同的疾病机制和临床管理,因此它们的预测和预防需要单独的研究。事实上,我们注意到sPTL和PPROM之间明显的失调模式,至少部分取决于采样窗口。具体来说,最终接受PPROM的女性与接受sPTL的女性相比,表现出更强的运动特异性细胞类型特征正相关。尽管如此,我们发现这两个亚群共享基质和蜕膜特征,进一步证实了导致早产的共同分娩途径。在妊娠中期,最终发生自发性早产的妇女表现出特定特征的失调,主要是母体蜕膜细胞,这与蜕膜时钟的概念一致。此外,我们的研究结果强调了两个关键事实:首先,sPTL和PPROM的潜在机制涉及不同细胞类型特征的改变,这可能使它们能够使用预测模型进行区分;其次,在未来的研究中考虑sPTL和PPROM之间的差异是很重要的,因为这些亚群的组合可能会降低检测特定生物标志物的能力。重要的是,这些结果表明用于预测建模的最佳单细胞特征可能在sPTL和PPROM之间有所不同,进一步支持早产综合征的多病因性质。
总之,本文的研究结果为足月分娩期间母胎信号和串扰提供了新的见解。我们的研究结果强调了单细胞技术在揭示人类胎盘分娩过程中涉及的新细胞类型和信号通路方面的实用性,并表明胎盘来源的单细胞特征在开发非侵入性生物标志物方面的潜在应用。
参考文献:
Garcia-Flores V, Romero R, Tarca AL, Peyvandipour A, Xu Y, Galaz J, Miller D, Chaiworapongsa T, Chaemsaithong P, Berry SM, Awonuga AO, Bryant DR, Pique-Regi R, Gomez-Lopez N. Deciphering maternal-fetal cross-talk in the human placenta during parturition using single-cell RNA sequencing. Sci Transl Med. 2024 Jan 10;16(729):eadh8335. doi: 10.1126/scitranslmed.adh8335. Epub 2024 Jan 10. PMID: 38198568; PMCID: PMC11238316.
