【背景】
DC 是「Dendritic Cells」的缩写,中文全称为「树突状细胞」,因其成熟时伸出 许多树突样或伪足样突起而得名。DC 是由 2011 年诺贝尔奖获得者、加拿大 籍科学家 Ralph M. Steinman 于 1973 年发现的,是目前发现的功能最强的抗原递呈细胞 (Antigen Presenting Cells, APC)。已证实,DC 是唯一能够显著刺激初始 T 细胞(Naïve T cells)增殖的 APC,而其它种类的 APC(如单核巨噬细胞,B 细胞等)仅能刺激已活化 的或记忆性的 T 细胞,因此 DC 是机体适应性 T 细胞免疫应答的始动者,在肿瘤免疫中发挥着极其重要的作用。
【培养原理】
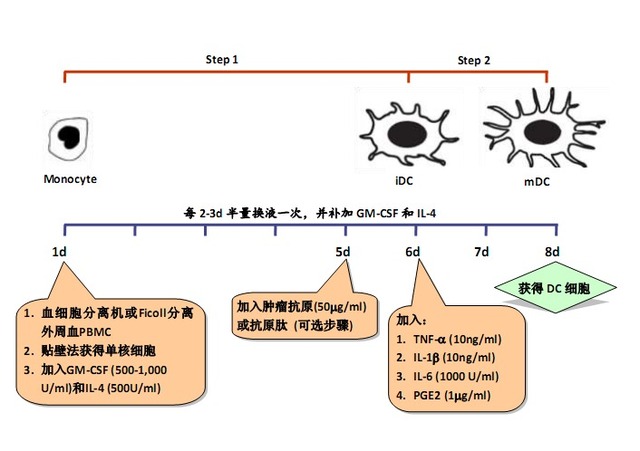
因为 DC 需从其它种类细胞诱导分化而来,且可分为不同的成熟阶段,所以通常分为 2 个步骤进行培养:
Step 1:从 DC 的祖细胞(如单核细胞)诱导分化为未成熟 DC(immature DC,iDC);
Step 2:从 iDC 诱导分化为成熟 DC(mature DC,mDC)。
Step 1:
GM-CSF(粒细胞巨噬细胞集落刺激因子):
GM-CSF 是一种造血生长因子,在体外可刺激中性粒细胞和巨噬细胞集落的形成, 并具有促进早期红巨核细胞、嗜酸性祖细胞增殖和发育的功能。GM-CSF 是最早被鉴定 出对 DC 培养有作用的细胞因子之一。
GM-CSF 在 DC 培养中的功能是促进单核细胞向大巨噬样细胞分化,细胞表面 MHC II 类分子的表达得以提高,从而增强细胞的抗原递呈功能。此外,GM-CSF 也可促进 DC 的存活。
IL-4(白细胞介素-4)
IL-4 在由单核细胞诱导成 DC 的过程中发挥的作用是抑制巨噬细胞的过度生长,从 而引导单核细胞向 DC 方向分化。 若培养体系中不加 IL-4,单核细胞将分化为巨噬细 胞。同时,IL-4 还有降低细胞表面表达 CD14 分子的能力。CD14 表达水平的降低是单 核细胞分化为 DC 的重要标志。
GM-CSF 和 IL-4 共同作用可使单核细胞定向分化为未成熟 DC,此时的 DC 具有较 强的抗原摄取和加工能力,但抗原递呈能力很弱。细胞表面中度表达 MHC I 类、II 类 分子和 B7 家族分子(CD80, CD86 等),但不表达或低表达 CD14。
Step 2:
TNF-α/IL-1β/ IL-6(肿瘤坏死因子-α/白细胞介素-1β/白细胞介素-6)
TNF-α,IL-1β和 IL-6 均为促炎症因子,在感染局部和肿瘤部位被诱导产生。体外 研究表明,这 3 种细胞因子均可下调未成熟 DC 的巨胞饮作用和表面 Fc 受体的表达, 使细胞内 MHC II 类分子区室(class II compartment)消失,但能够上调细胞表面 MHC I 类、II 类分子和 B7 家族分子(CD80, CD86 等)的表达, 使未成熟 DC 分化为成熟 DC, 此时 DC 的抗原摄取和加工能力明显减弱,而抗原递呈能力显著增强,可极强地激活 T 细胞。
TNF-α/IL-1β/IL-6 三因子组合可在无牛血清培养条件下诱导 DC 的完全成熟,从而 制备出可以应用于临床的 DC。
PGE2(prostaglandin E2,前列腺素 E2)
PGE2 也是炎性介质,可由 TNF-α,IL-1 和 LPS(脂多糖)等炎症信号诱导产生。在
TNF-α/IL-1β/IL-6 成熟诱导组合中添加 PGE2,可进一步提高 DC 的产量、成熟度、迁 移能力和免疫激活能力。
这里尤为重要的是 DC 迁移能力的提高。因为 TNF-α/IL-1β/IL-6 诱导成熟的 DC 迁 移能力较弱,不能很好地到达淋巴结而激活 T 细胞。而添加 PGE2 后诱导成熟的 DC 因 表面趋化因子受体的高表达,而更容易迁移至淋巴结,而引起机体对抗肿瘤的免疫反应。
因此,TNF-α/IL-1β/IL-6/PGE2 组合(见下表)广泛应用于临床,并被认为是制备成熟 DC 的「金标准」
| 组份 | 工作浓度 |
| TNF-a | 10ng/ml |
| IL-1β | 10ng/ml |
| IL-6 | 1000 U/ml |
| PGE2 | 1mg/ml |
【注意事项】
1. DC 的来源:
DC 有多种来源,包括外周血单核细胞(Monocyte)、脐带血 CD34+细胞、骨髓和胎 肝等,但因外周血单核细胞最容易获取、数量也最多,所以临床上被广泛用作 DC 的来源细胞。
2. DC 的成熟度:
我们知道,DC 有未成熟和成熟两种状态,即 iDC 和 mDC,而 DC 的抗原递呈能力 与其成熟状态密切相关。
iDC 的抗原摄取和加工能力较强,但抗原递呈能力很弱。在体外培养时,iDC 去除 细胞因子(即 GM-CSF 和 IL-4)后,会逆转为巨噬细胞,且即使在细胞因子的维持下,未 成熟 DC 的功能也不是激活 T 细胞,而是抑制 T 细胞的增殖。
mDC 则正好相反,其抗原摄取和加工能力很弱,但具有很强的抗原递呈能力。因 而可以激活 T 细胞,引起免疫反应。而且 DC 成熟后即使在培养体系中去除细胞因子, 仍能保持 DC 的状态和功能,不会发生逆转。
因此可以看出,DC 必须完全成熟后才能用于免疫治疗。
3. DC 的无牛血清培养:
DC 最初都是在含有小牛血清(Fetal Calf Serum,FCS)的培养体系中获得的,但我们 知道,如果想将 DC 应用于临床治疗,则不能使用 FCS。然而如果不用 FCS,DC 则无 法培养成功。科学家最先想到的是用 10%的人自体血浆来替代 10%的 FCS,但实验结果表明,人单核细胞在含 10%人自体血浆的培养液中培养,用 GM-CSF 和 IL-4 诱导 7 天后,大多 数单核细胞仍贴壁,半悬浮的 iDC 数量非常少。后来经过不断摸索发现,在无血清培 养基中添加 1%人自体血清对于从单核细胞诱导成为 iDC 效果最好。更为困难的步骤是如何在无牛血清培养体系中将 iDC 诱导成为 mDC。TNF-α和 IL-1β 在含牛血清培养体系中均是很好的 DC 成熟诱导剂,而在无牛血清培 养体系中,两者均无效或效果微弱,即在无牛血清清培养体系,TNF-α和 IL-1不能将 iDC 诱导成为 mDC,或仅能诱导一小部分 iDC 成为 mDC。
后来的研究表明,用单核细胞条件培养基(Monocyte-conditioned medium,MCM), 即单核细胞在包被有免疫球蛋白的细菌平皿上无牛血清培养 24 小时后得到的培养上清, 可在无牛血清培养体系中诱导 DC 的完全成熟。因此认为,1%人自体血浆+ MCM 可能 成为临床上获得成熟 DC 的标准方法。
但每次制备的 MCM 的一致性很难保证,导致每批 MCM 必须经过测试后才能确定 最适用量,这给临床应用带来阻力和不稳定性。所以,人们一直想寻找到能够替代 MCM 的化学成分明确的成熟诱导组合。
1997 年,德国美因茨大学(Mainz University)的 Jonuleit 等取得了突破性进展,他们 发现 TNF-α,IL-1β 和 IL-6 三种细胞因子的组合可完全替代 MCM,在无牛血清培养体 系中能够将 iDC 诱导成完全成熟的 DC。
4. PGE2 与 DC:
德国美因茨大学的 Jonuleit 在证明 TNF-α,IL-1β 和 IL-6 三种促炎症因子的组合可 完全替代 MCM,在无牛血清培养体系中能够将 iDC 完全诱导成熟的同时,也发现另一 种炎症介质,即 PGE2 可进一步提高 DC 的产量、成熟度、迁移能力和免疫激活能力, 也就是说在 TNF-α,IL-1β 和 IL-6 之外添加 PGE2 可获得更为成熟和高效的 DC,这样 会提高临床上 DC 的治疗效果。
PGE2 常被加入 DC 成熟诱导组合中最重要的原因是其可提高成熟 DC 的迁移能力, 这样可使 DC 更容易到达淋巴结,从而引起免疫反应、治疗肿瘤。但我们也应该注意以下几点:
1) PGE2 不能添加到 DC 诱导分化的 Step 1 中,如加入,DC 的分化将会被抑制;
2) 我们知道,能诱导机体产生 Th1 反应的 DC(很多文献中称为 DC1)有助于多种 肿瘤,如黑色瘤和恶性胶质瘤等的治疗。
实验研究表明,在成熟诱导因子(TNF-α/IL-1β)中加入 PGE2 倾向于将 iDC 诱导 成为成熟的 DC2,而非 DC1,该 DC 会诱导产生 Th2 反应。所以很多人在试图 寻找能够诱导 DC1 的最佳成熟诱导组合,如 TNF-α/IL-1β/IFN-α/IFN-γ/poly-I:C, TNF-α/IL-1β/IFN-γ/PGE2(低浓度)/R848(TLR7/8 激动剂)和 IFN-γ/LPS 序贯组合 等,但这些新组合都未得到临床上的充分验证,也就没有真正用于临床级别 DC 的制备。
3) 其实,各家的研究结果不尽相同。比如,TNF-α/IL-1β/IL-6/PGE2 组合的创立者
---德国美因茨大学的 Jonuleit 在研究时就发现,添加 PGE2 诱导成熟的 DC 在刺 激 T 细胞时可显著提高其分泌的 IFN-γ 产量,而对 IL-4 和 IL-10 的分泌无影响, 提示添加 PGE2 诱导成熟的 DC 具有诱导 Th1 反应的倾向。
总之,培养体系中是否加入小牛血清,以及所使用的无血清培养基种类不同等诸多 因素都可能导致添加 PGE2 诱导成熟的 DC 在性质上的差异,因此临床上制备 DC 时最 好能够做充分的前期研究,然后确定用于治疗某种肿瘤最好的制备方法。
【DC 的制备】
1. 外周血单个核细胞的采集
1.1 用血细胞分离机采集患者自身的外周血单个核细胞 80 - 100ml;
1.2 淋巴细胞分离液密度梯度离心法进一步纯化单个核细胞(PBMC)。
1.3 无血清培养液洗涤 2 次,获得纯度在 90%以上的 PBMC,细胞数量需达到 1-3 x 108。
2. (可选步骤) 肿瘤抗原的制备
用于负载 DC 的肿瘤抗原可以是肿瘤特异性抗原肽(Tumor-Specific Antigens, TSA)或肿瘤相关抗原(Tumor-Associated Antigens, TAA),也可以是肿瘤全细胞抗原。
用 TSA 或 TAA 负载的 DC 具有很好的靶向性,但该方法具有已确定的肿瘤特异性 抗原或抗原肽种类少和单一抗原的免疫攻击经常无法杀伤肿瘤细胞等缺陷。而用肿瘤全 细胞抗原负载 DC 可克服这些缺陷,因为此时无需知道哪些抗原是肿瘤细胞的 TSA 或 TAA,而且全抗原中的多种不同肿瘤抗原冲击 DC 可诱导产生针对不同抗原决定簇的细 胞毒 T 淋巴细胞(CTL)克隆,从而实现对肿瘤细胞的有效杀伤。
肿瘤细胞全抗原负载 DC 的方法很多,包括用肿瘤细胞裂解液负载 DC、用凋亡肿 瘤细胞负载 DC、用坏死或死亡的肿瘤细胞负载 DC,用肿瘤活细胞负载 DC,和将肿瘤 细胞与 DC 融合等。目前临床上常用的是用肿瘤细胞裂解液负载 DC,因该方法简单、 快速、有效。
反复冻融是获得肿瘤细胞裂解液的常见方法,具体步骤如下:
2.1 手术切除肿瘤标本,无菌条件下,将坏死组织和癌旁非肿瘤组织去除干净;
2.2 无菌生理盐水洗 3 次;
2.3 用无菌的组织剪将肿瘤组织剪碎,加入 RPMI 1640 培养基,充分研磨;
2.4 200 目无菌网过滤后收集单细胞悬液;
2.5 用 RPMI 1640 培养基重悬细胞至 1-2 x 107/ml,装入 5ml 无菌冻存管中;
2.6 将冻存管浸入液氮中速冻,10 min 后取出,再迅速放入 37oC 水浴中解冻 10 min。 反复 3-5 次;
注:也可以-80oC/37oC 反复冻融 3-5 次。
2.7 将肿瘤裂解物加入离心管中,3000rpm,离心 10min;
2.8 收集上清,0.22m 滤膜过滤除菌,留样检测蛋白含量及细菌、真菌和支原体;
2.9 -80oC 保存备用。
3. DC 细胞的培养及鉴定
3.1 步骤 1 中获得的 PBMC 用无血清培养液调整细胞浓度至 2 x 106/ml,置于培养瓶内;
3.2 37℃,5% CO2 培养箱中孵育 2h,以使单核细胞贴壁;
3.3 洗去悬浮细胞,在贴壁细胞中加入含重组人 GM-CSF(500-1,000U/ml)和重组人 IL-4 (500U/ml)的无血清培养液,37℃,5% CO2 培养箱中培养,诱导单核细胞向 DC 细 胞分化;
3.4 每 2-3d 半量换液一次,并补足细胞因子;
3.5 (可选步骤) 在培养的第 5d, 加入步骤 2 中获得的肿瘤抗原 50 μg/ml,对 DC 进行 抗原负载;
注:若不对 DC 进行抗原负载,该步省略。
3.6 在培养的第 6d,加入重组人 TNF-α(10ng/ml),IL-1β(10ng/ml),IL-6(1000U/ml)和 PGE2(1μg/ml),诱导 DC 细胞成熟;
3.7 在培养的第 7d 或第 8d,收获 DC 细胞,其数量应达到 1×106 个以上;
3.8 DC 的质检:
3.8.1 活细胞比例:台盼蓝染色验证活细胞应在 90%以上;
3.8.2 形态学观察:>90%细胞半悬浮,细胞有多个树突样突起;
3.8.3 细胞表型分析(见下图):流式细胞术检测 DC 细胞表面 CD14、HLA-DR、 CD40、CD80、CD83 和 CD86 等分子的表达,成熟的 DC 不表达 CD14, 而高表达其他分子。CD83 是成熟 DC 的特异性标志,在单核细胞和不成熟 DC 表面不表达或低表达。
3.8.4 无菌检测:收获细胞前取少量培养物进行细菌、真菌培养,并检测支原体、 衣原体,均应为阴性;
3.8.5 内毒素检测:收获细胞前取少量培养物,回输前,用鲎试剂检测内毒素含量, 标准:内毒素<0.5 EU/ml。

【DC 培养试剂推荐】
| 生产商 | 产品名称 | 产品编号 | 产品规格 | 使用浓度 |
| PeproTech | 重组人 GM-CSF (Animal Free) | AF-300-03 | 5mg/20mg/50mg/100mg/250mg/500mg/1mg | 50-100ng/ml |
| PeproTech | 重组人 IL-4 (Animal Free) | AF-200-04 | 5mg/20mg/50mg/100mg/250mg/500mg/1mg | 100ng/ml |
| PeproTech | 重组人 TNF-a (Animal Free) | AF-300-01A | 10mg/50mg/100mg/250mg/500mg/1mg | 10ng/ml |
| PeproTech | 重组人 IL1-b (Animal Free) | AF-200-01B | 2mg/10mg/50mg/100mg/250mg/500mg/1mg | 10ng/ml |
| PeproTech | 重组人 IL-6 (Animal Free) | AF-200-06 | 5mg/20mg/50mg/100mg/250mg/500mg/1mg | 100ng/ml |
| PeproTech (BioGems) | PGE2 (前列腺素 E2) | 3632464 | 10mg/50mg | 1mg/ml |
注:Animal Free 意为无动物成分。无动物成分的重组细胞因子在生产过程中不会有任何动物源性物质,尤其是牛的病原体和蛋白的混 入,使得最终获得的重组人蛋白中不含任何动物成分。这样可避免动物病原体(如疯牛病,克雅氏病等)的污染及外源蛋白引起的机体异种排斥和过敏反应,因此细胞治疗的体外细胞培养过程中最好使用无动物成分的重组细胞因子。
【DC 鉴定试剂推荐】
| 生产商 | 产品名称 | 产品编号 | 克隆号 | 荧光标记 | 产品规格 |
| PeproTech (BioGems) | 抗人 CD14 荧光标记抗体 | 6211 | 61D3 | FITC/PE/APC/PerCP-Cy5.5 | 25tests/100test |
| 抗人 CD40 荧光标记抗体 | 2511 | 5C3 | FITC/APC | 25tests/100test | |
| 抗人 CD80 荧光标记抗体 | 2911 | 2D10.4 | FITC/PE | 25tests/100test | |
| 抗人 CD83 荧光标记抗体 | 5911 | HB15e | FITC/PE | 25tests/100test | |
| 抗人 CD86 荧光标记抗体 | 8911 | IT2.2 | PE | 25tests/100test | |
| 抗人 HLA-DR 荧光标记抗体 | 74111 | LN3 | FITC/PE/APC/PerCP-Cy5.5 | 25tests/100test |
注:用于 DC 鉴定的表面标志物的表达在流式图上均呈现单个峰,且多数情况下不能与阴性峰完全区分开来。为避免多色分析时补偿调 节不好导致结果的不准确性,建议最好用单标,最多用双标来做 DC 表面标志的分析,而且必须使用同型对照,而非空白细胞对照来 排除背景染色。
【参考文献】
[1] Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J. Exp. Med. 1973; 137 (5): 1142–62.
[2] Bender A, Sapp M, et. al. Improved methods for the generation of dendritic cells from nonproliferating progenitors in human blood. J Immunol Methods. 1996; 196(2):121-35.
[3] Romani N, Reider D, et. al. Generation of mature dendritic cells from human blood. An improved method with special regard to clinical applicability. J Immunol Methods. 1996; 196(2):137-51.
[4] Jonuleit H, Kühn U, et al. Pro-inflammatory cytokines and prostaglandins induce maturation of potent immunostimulatory dendritic cells under fetal calf serum-free conditions. Eur J Immunol. 1997; 27(12):3135-42.
美国PeproTech(派普泰克)公司中国代表处 商家主页
地 址:  江苏省苏州市工业园区星湖街218号A1北座4楼L03
联系人: PeproTech
电 话: 0512-68325983,4000053055
传 真: 0512-68325993
Email:peprotech.infochina@thermofisher.com
