人体肠道微生物群源源不断地将来自宿主和饮食的天然产物转化为生物活性代谢物。肠道免疫具有高度组织区域化的特征,小肠是机体消化吸收膳食营养物质的主要场所,膳食脂肪可经脂解作用形成游离脂肪酸并被机体作为必须微量营养元素所吸收。而肠道共生菌将一些长链不饱和脂肪酸(如亚油酸)修饰成各种脂肪酸异构体,这些异构体调节宿主代谢并具有抗癌特性。然而,目前对这种饮食-微生物FA异构化网络如何影响宿主的粘膜免疫系统仍缺乏深入研究。
2023年6月,中科院分子细胞科学卓越创新中心宋昕阳研究员与肠道菌群研究先驱、美国哈佛医学院Dennis L. Kasper院士共同通讯在Nature(IF=64.8)上发表了题为“Gut microbial fatty acid isomerization modulates intraepithelial T cells”的研究论文,发现肠道微生物以亚油酸(Linoleic Acid, LA)等常见脂肪酸为食,并将其转化为共轭亚油酸(亚油酸的同分异构体,CLA)。这种副产物作为生物级联反应的信号,最终刺激一种特定类型的免疫细胞亚群CD4+CD8αα+上皮内淋巴细胞(CD4+CD8αα+ IELs)的发育并驻留在小肠中。这种级联反应被打断的小鼠更容易被一种常见的食源性病原体——鼠伤寒沙门氏菌所感染。(麦特绘谱提供长链脂肪酸靶向定量检测分析服务)

肠道FAs诱导CD4+CD8αα+ IELs
研究发现,CD4+CD8αα+ IELs主要存在于无特定病原体(SPF)小鼠而非无菌(GF)小鼠的小肠上皮内区域,因此作者推测小肠内细菌通过改变来自宿主饮食的代谢物来促进CD4+CD8αα+ IELs的诱导。比较不同饲粮喂养SPF小鼠肠道组织,发现饲喂营养丰富粮食的SPF小鼠的CD4+CD8αα+ IELs水平显著高于基本营养饮食的SPF小鼠,饲粮对CD4+CD8αα+ IELs水平的影响仅限于小肠(十二指肠、空肠和回肠),在盲肠和结肠中未观察到。这表明,饮食来源的分子,或由宿主或其共生微生物修饰的饮食分子,可能对小肠中CD4+CD8αα+ IELs的诱导至关重要。
接下来,作者试图确定饮食和肠道因素是否负责调节小肠中CD4+CD8αα+ IELs水平,首先排除了胆汁酸(BA)本身及胆汁酸信号级联影响后,最终将注意力集中在各种脂肪酸上。在给小鼠喂食特定脂肪酸后,他们发现,食用一种被称为亚油酸(LA)的长链脂肪酸的小鼠开始在它们的小肠中出现CD4+CD8αα+ IELs细胞。
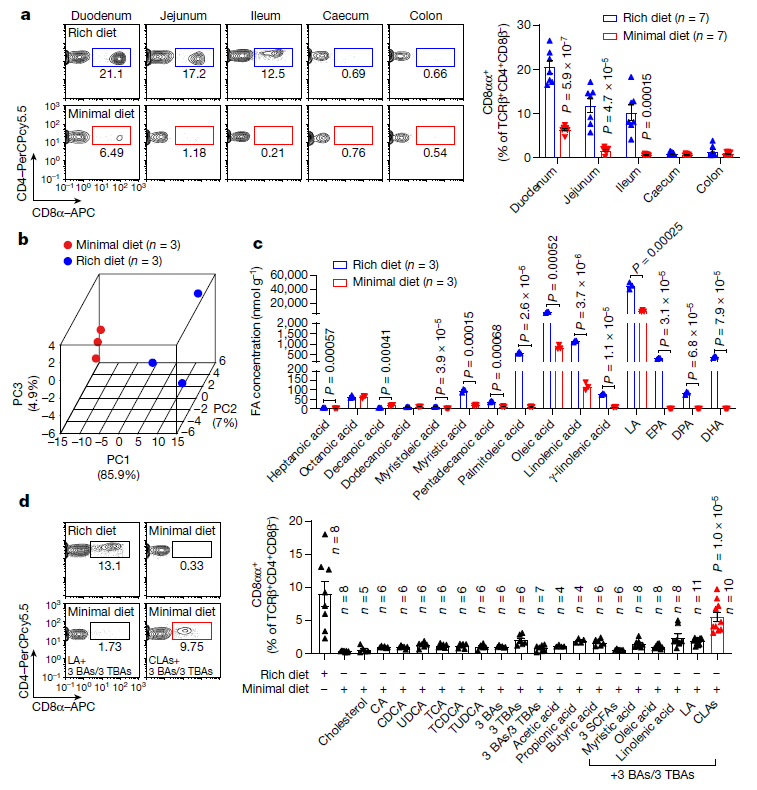
图1. 肠道LCFA代谢物对上皮内CD4+CD8αα+细胞的维持至关重要
微生物是LA异构化的必要条件
一些肠道细菌,如肠球菌、乳杆菌、双歧杆菌、瘤胃球菌和毛螺科,可以通过亚油酸异构酶(LAIs)将LA转化为CLAs。小鼠肠道菌群组成在摄入低营养饮食后发生了变化,其中这些小鼠的回肠中几种产生CLA的细菌丰度同时降低。作者进一步确定饮食和微生物群对肠道中CLA水平的影响,并发现细菌生物转化过程对肠道CLA的产生至关重要。为了进一步确定LAI基因阳性细菌中的LCFA异构化途径是否参与回肠CD4+CD8αα+ IELs的诱导,选择两种CD4+CD8αα+ IELs诱导株: 粪肠球菌MMH594和粪肠球菌OG1RF。在失去将LA转化为CLAs的能力后,这些粪肠球菌菌株无法诱导回肠产生CD4+CD8αα+ IELs。这表明,小鼠小肠内CD4+CD8αα+ IELs的产生需要由LAI阳性共生菌编码的LA代谢途径。
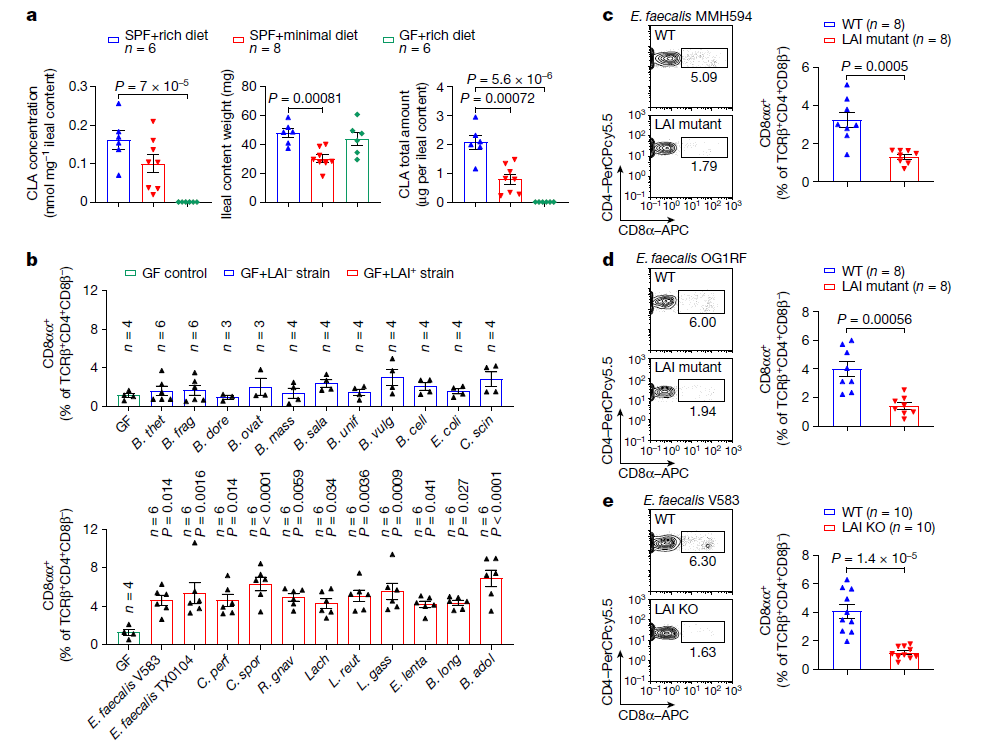
图2. 肠道细菌通过LCFA异构化途径控制上皮CD4+CD8αα+细胞
CLAs通过HNF4γ诱导CD4+CD8αα+ IELs
饲料中的LA可被微生物代谢修饰,其产物CLAs具有宿主免疫调节特性。因此,进一步探讨宿主如何识别微生物CLA信号来维持回肠CD4+CD8αα+ IELs稳态。表达CD8 α的SPF小鼠回肠IELs转录组学分析显示,CD4+CD8αα+ IELs与TCRβ+CD8αβ+和TCRβ+CD8αα+ IELs的基因表达模式明显不同。尽管所有三个IEL群体都表达了与CD8+ T细胞中细胞毒性T淋巴细胞程序相关的基因,但CD4+CD8αα+ IELs保留了许多由CD4+细胞系编码的细胞因子的基本表达,这些细胞因子对维持肠道屏障功能很重要,例如IL10、IL17a、IL17f和IL22。
进一步分析发现CD4+CD8αα+ IELs选择性地表达两种核受体: HNF4α和HNF4γ,这两种受体已被报道为肠道上皮细胞FA代谢的关键调节因子。其中HNF4α在整个胃肠道中高度表达,而HNF4γ主要在小肠中表达。CD4+ T细胞中HNF4α的缺失并不影响回肠CD4+CD8αα+细胞或其他IEL对照物的水平。值得注意的是,TF-ThPOK和受损的CD4谱系水平升高HNF4g缺陷小鼠CD4+IELs中CD8αα+细胞频率。通过比较HNF4g缺陷小鼠及其对照组小鼠IECs中免疫信号相关基因的表达,发现这些免疫基因在Hnf4g缺陷的IECs中没有下调,这表明在Hnf4g缺陷小鼠中存在一种独特的调节IELs的机制。接下来,作者通过过继性地将Hnf4g正常或缺乏Hnf4g的初始CD4+ T细胞转移到Tcrb敲除小鼠体内,发现内在的HNF4γ可调节回肠CD4+CD8αα+ IELs。
为确定肠道CLAs是否通过HNF4γ调节回肠CD4+CD8αα+ IELs,作者用六种B胆汁酸(CA、CDCA、UDCA、TCA、TCDCA和TUDCA)混合乳化的CLAs治疗Hnf4g缺陷小鼠,发现CLA-BA混合物能够恢复低营养饮食的Hnf4g窝鼠的CD4+CD8αα+ IELs的回肠频率;而单独补充CLA无法恢复Hnf4g缺陷小鼠的回肠CD4+CD8αα+ IELs水平,这表明微生物CLA – Hnf4γ轴在调节这种IEL群体中起着关键作用。
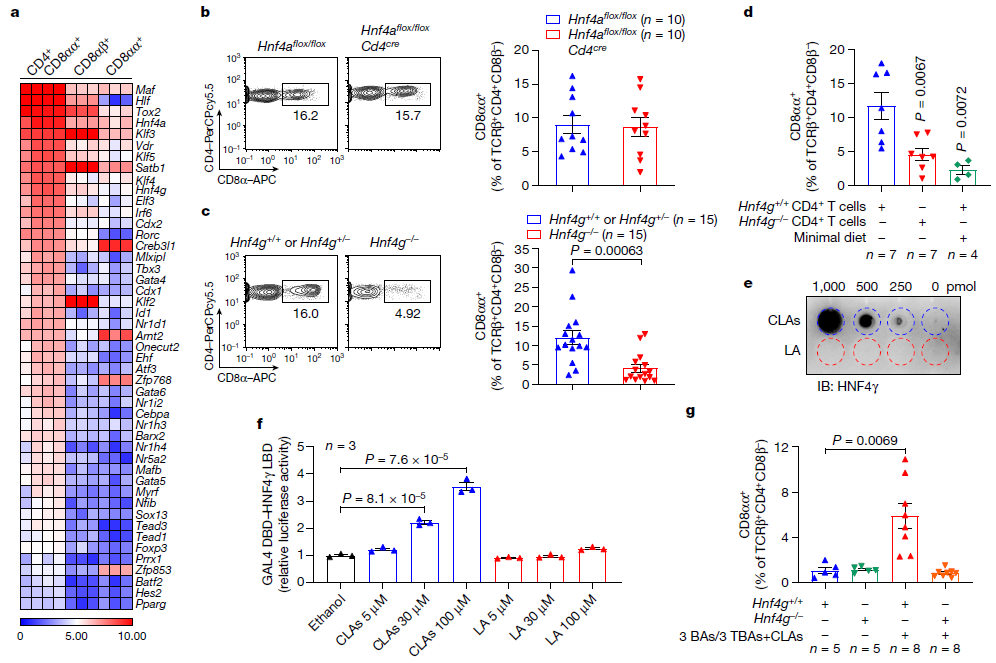
图3. 肠道CLAs通过HNF4γ调节上皮内CD4+CD8αα+细胞
HNF4γ通过IL-18受体下调ThPOK
接下来,作者探究CLA-HNF4γ轴调节CD4+CD8αα+ IELs的机制。三个表达CD8 α的TCRβ+ IEL亚群的转录组比较显示,CD4+CD8αα+ IELs高水平表达IL13ra1和IL18r1。检测相应细胞因子缺陷小鼠的回肠CD4+CD8αα+ IELs水平表明,IL-18信号传导在控制这种IEL群体中具有潜在作用。虽然HNF4γ缺乏或低营养饮食不会影响回肠IL-18水平,但HNF4γ可以结合回肠CD4+ IELs中IL18r1位点的转录起始位点(TSS)。
此外,低营养饮食导致CD4+ IEL表面IL-18R1表达受损。通过补充CLA,小鼠CD4+ IELs中IL-18R1水平的恢复依赖于HNF4γ。这表明CLA-HNF4γ轴在控制CD4+ IELs中IL18r1介导的信号传导中是至关重要的。进一步实验发现在IL18缺陷小鼠和IL18r1缺陷小鼠的CD4+ IELs中ThPOK+种群增加,而在这些小鼠的回肠中其他TCRβ+ IELs保持完整。因此,肠道CLAs激活HNF4γ促进IL-18R1在CD4+ IEL中的表达,而IL-18反过来通过其受体信号下调ThPOK,使CD4+CD8αα+ IELs分化。
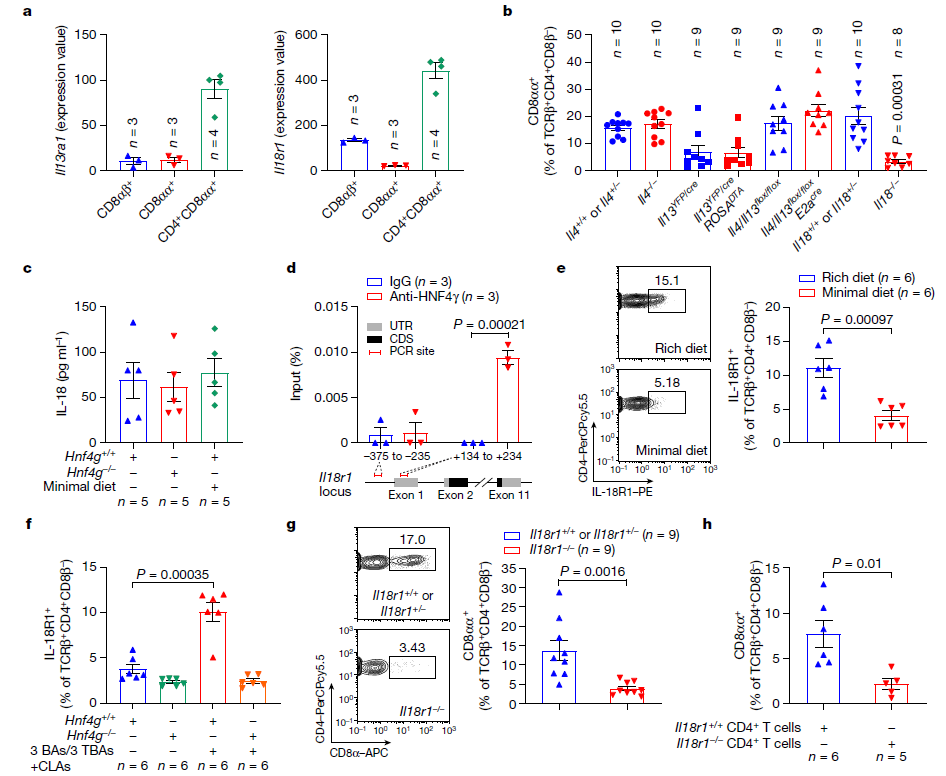
图4. 肠道CLA-HNF4γ轴通过IL-18信号传导诱导上皮内CD4+CD8αα+细胞
CLA-HNF4γ轴调控肠道感染
据报道,CD4+CD8αα+ IELs可维持肠道稳态,这些IELs表达抗感染和屏障修复功能的特征基因。本研究分析了CLA-HNF4γ级联是否调节鼠伤寒沙门氏菌(STm)感染模型中的肠道炎症反应。首先发现饲料中添加CLA可以恢复小鼠的回肠CD4+CD8αα+ IELs。此外,给予CLA+低营养饮食的小鼠对STm感染的抵抗力与营养丰富饮食的小鼠一样,而单纯喂食低营养饲粮的小鼠表现出更高的死亡率、严重的上皮破坏、血清炎症细胞因子水平增加和细菌传播到非肠道器官增多。因此,CD4+ T细胞中的HNF4α信号在STm感染的控制中是不可缺少的。然而,Hnf4g缺陷小鼠比其同窝小鼠更容易感染STm,CD4+ T细胞中的HNF4γ信号也显示出对STm感染的保护作用。表明干预CLA-HNF4γ轴可调控肠道感染程度。
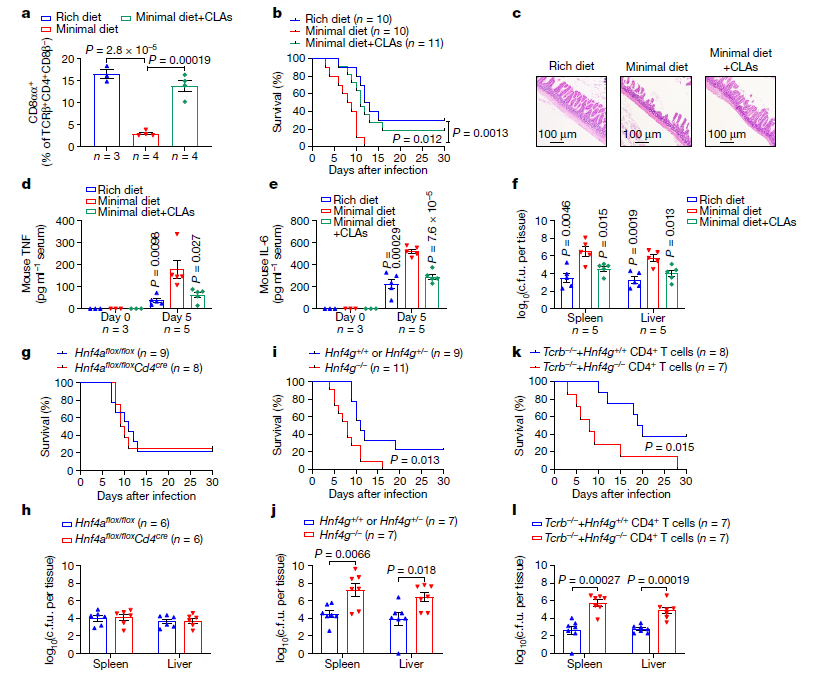
图5. CLA-HNF4γ轴控制肠粘膜感染
小结
本研究通过靶向代谢分析结合体内外机制研究,表明肠道菌群FA衍生物CLAs是通过HNF4γ介导的IL-18受体信号传导维持健康的CD4+CD8αα+ IELs池的重要分子因子,提出了一种膳食-微生物-宿主的三重互作信号网络调控机体黏膜稳态与抗感染免疫的新型功能机制。
原文文献
Song, X., Zhang, H., Zhang, Y. et al. Gut microbial fatty acid isomerization modulates intraepithelial T cells. Nature. 2023.
请扫描二维码阅读原文

绘谱帮你测
长链脂肪酸是一类复杂而又重要的膳食营养素,越来越多的研究揭示了其在肿瘤/癌症及肠道免疫等方面发挥的关键作用。上述研究由麦特绘谱提供长链脂肪酸的靶向定量检测服务,麦特绘谱针对中长链脂肪酸开发了基于GC-MS平台和LC-MS平台两套检测方法,相关项目成果已覆盖免疫、癌症、骨骼肌衰老等多个研究方向。
麦特绘谱专注于代谢组学与转化医学疾病研究领域,拥有成熟的代谢组学检测平台,以全定量靶向代谢组学技术为核心,包括全球独有技术Q1000,Q500、Q300、Q200和各类小分子代谢物单独检测方法共20+系列,兼顾非靶向代谢组学和代谢流技术。同时还有菌群16S测序、宏基因组学、转录组学和蛋白质组学等多组学及联合分析等全套解决方案。独家的检测技术、全面的数据报告及专业科研级别的售后探讨,助您科研探索之路不断创新和突破。欢迎联系获取详细资料!
往期回顾
1. 客户案例 | Theranostics:香港大学研究团队揭示SCD1/FADS2脂肪酸去饱和酶控制腹膜转移新机制
2. 客户案例 | JBC:多不饱和脂肪酸促进秀丽隐杆线虫脂滴快速融合
3. Physiol Rev | 脂肪酸在健康与疾病中的作用(上)
4. Physiol Rev | 脂肪酸受体在健康与疾病中的作用(下)
6. Nature Reviews | 治疗抵抗和肥胖背景下的肿瘤脂肪酸代谢
7. Nature Communications | 饱和脂肪酸与记忆形成相关

