国产mRNA疫苗将开展III期临床试验
4月份,全球各地都在紧罗密布的开展COVID-19疫苗注射工作,随着疫苗接种量的增加和人群的不断覆盖,新发感染病例在不断的减少,但印度的疫情却因一系列的聚集活动和防控措施的松动导致感染人数呈现出指数级的增长。针对快速增加的感染人数,除了严格的防控管制措施外,疫苗的快速接种也是非常重要的一环,关于COVID-19疫苗情况,4月份有不少新的进展。
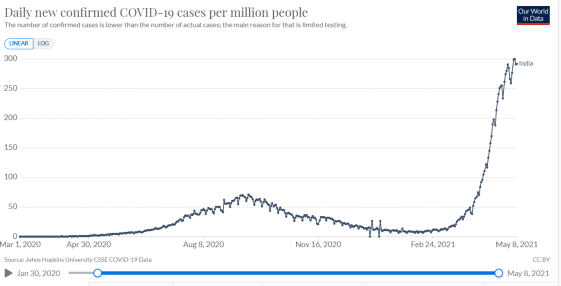
数据来源:ourworldindata官网
研究进展
4月1号Nature Medicine发表的一篇关于辉瑞mRNA疫苗有效性的文章。文章实验发现单一疫苗剂量引起的刺突特异性IgG抗体水平和ACE2抗体结合抑制反应与没有先感染的个体接种两剂疫苗后所见的相似。并通过高通量ACE2抑制中和替代物试验进一步评估了诱导中和抗体的能力发现,第二剂疫苗并不能为先前感染的个体提供比单剂疫苗更大的抗体中和效价,结果表明单剂量的疫苗对于有SARS-CoV-2感染史的个体是足够的,这种高潜力不仅体现在抗S抗体水平上,也体现在ACE2抑制试验的结果上。[1]
4月6号由美国国家过敏和传染病研究所(NIAID)的学者领衔在《新英格兰医学杂志》(NEJM)发表的文章对Moderna COVID-19疫苗接种者的长期跟踪结果表明:Moderna mRNA疫苗带来的免疫力至少维持6个月。[2]
4月22日,Nature Medicine发表的一篇关于Pfizer/BioNTech的COVID-19疫苗BNT162b1在中国开展的1期临床试验结果,研究证实了基于mRNA的SARS-CoV-2候选疫苗BNT162b1通过体液免疫及T细胞免疫双重机制,具有良好的免疫原性以及耐受性。目前,对中国成年人进行的二期临床试验也在加紧开展试验中[3],BioNTech创始人兼首席执行官UgurSahin在一次记者会上称其研发的mRNA COVID-19疫苗BNT162b2或将于7月前在中国获批。

产业化进展
4月8日,苏州艾博生物科技有限公司宣布完成6亿元B轮融资,由人保资本、国投创业和云锋基金等专业医疗投资机构参与本轮融资,融资资金主要用于加速COVID-19疫苗研发以及建设疫苗产业基地并进一步扩充mRNA技术产品管线。
4月10日,中国疾病预防控制中心主任高福在2021全国疫苗与健康大会上呼吁:mRNA技术对传染病、艾滋病、遗传病、罕见病、肿瘤将提供各种机会,希望在研发传统疫苗的同时应考虑到 mRNA疫苗可能给人类带来的无限思考并呼吁大家要关注mRNA疫苗。
4月13日,据央广网报道:苏州艾博创始人英博透露,艾博生物联合军事科学院军事医学研究院、云南沃森生物共同研制的新型冠状病毒mRNA疫苗(ARCoV)已进入II期临床尾声,进展顺利。将在5月与泰格医药合作开展海外III期临床试验,进而实现中国mRNA疫苗“零”的突破。[4]
4月22-23日,第八届国际生物药大会暨生物技术仪器设备与试剂展览会(BioCon 2021)在魔都上海召开,翌圣生物受邀参与此次大会,由翌圣生物医药产品线首席科学家滕以刚博士在专场六:核酸疫苗与药物研发”带来《如何生产高品质mRNA药物原料》的主题演讲引起了与会各界的强烈共鸣。

mRNA疫苗开发流程包括病原体识别、测序、mRNA体外合成和修饰、纯化等操作。mRNA疫苗的研究制备需要多种原料来保证疫苗的成功开发,翌圣生物作为国内分子酶产业创新领导者,通过先进的分子酶双向技术平台、大规模蛋白发酵纯化技术平台,目前已成功开发各类分子酶相关原料的产品。翌圣生物提供mRNA疫苗研究所需GMP级别原料并获得广大用户的认可。
mRNA体外合成
mRNA疫苗的生产主要是通过体外合成(IVT),其过程主要是以DNA为模板加上对应的底物和缓冲液通过体外转录得到。翌圣生物经过匠心研发,开发出的高性价比的Hifair® T7 High Yield RNA Synthesis Kit高产量体外合成试剂盒包含一整套的RNA合成所需试剂,并配有详细的教程。
产品特点
高产量:2h内产生100-200µg,单次放大反应可产生毫克级RNA
多功能—适用于长片段和短片段RNA转录
灵活性—可获得无标记、标记以及加帽的RNA
测试数据
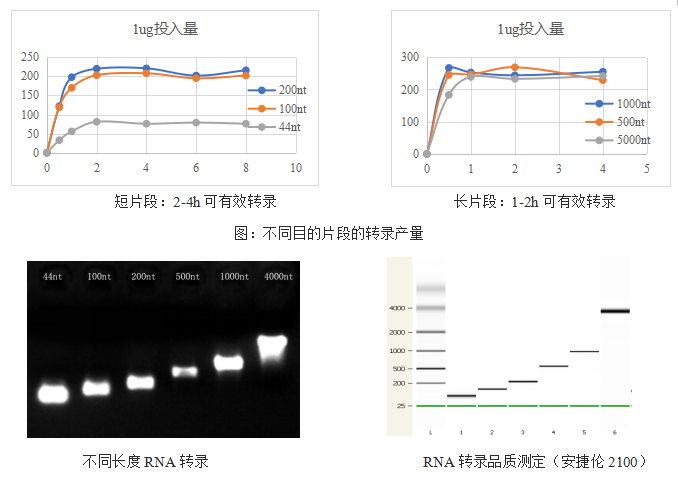
mRNA修饰
由于RNA的稳定性较弱,因此合成后的mRNA稳定性是必须要重点关注的问题。通常需要通过在5’端加上帽子结构和3’端加ployA尾加强mRNA的稳定性。翌圣提供低残留和高效加帽的Vaccinia Capping Enzyme(牛痘病毒加帽酶)是经过GMP工艺要求生产获得,完全满足疫苗生产所需。
产品特点
生产工艺:GMP工艺生产
、残留:无核酸酶、内毒素含量低
来源:大肠杆菌重组表达
纯度高:纯度 >95%(SDS-PAGE)
比活:~160000U/mg(BCA)
GMP级别质检
|
质检项目 |
蛋白酶 |
核酸外切酶 |
切口酶 |
RNA酶 |
内毒素 |
宿主蛋白 |
宿主核酸 |
无菌检测 |
病原体 |
支原体 |
… |
|
√ |
√ |
√ |
√ |
√ |
√ |
√ |
√ |
√ |
√ |
|
注:具体质检标准及数据参考具体COA
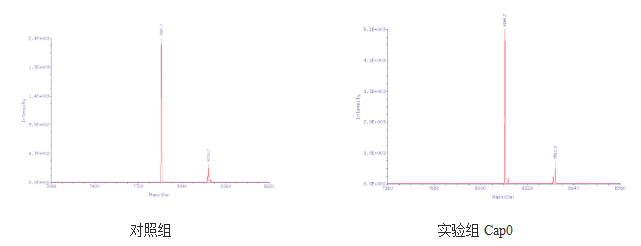
加帽效率
质谱测定酶的加帽效率,并与对照品进行对比,可以发现翌圣的加帽效率比较高,获得的产物的纯度也较高。
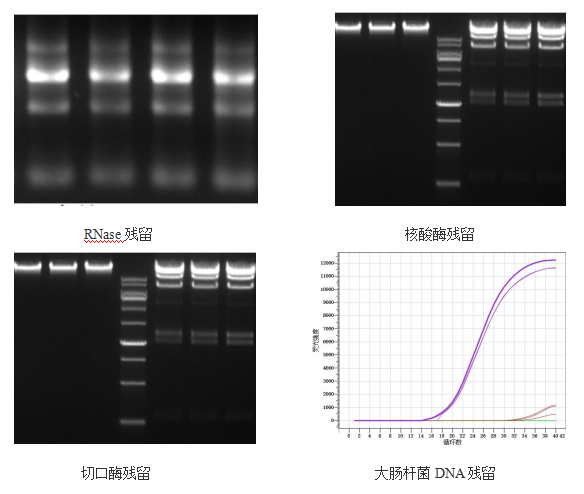
残留检测
分别检测Rnase、核酸酶、切口酶、大肠杆菌DNA残留,经检测结果显示,成品无相关酶的残留,且表达的宿主DNA残留也达到了药典要求标准。
翌圣生物作为分子酶领域创新领导者,专注为您提供高品质的分子酶产品及相关试剂盒,为您的科学研究和药物及疫苗的开发提供更多选择和方便,也为人类的未来健康事业奉献一份力量。
相关产品
|
产品名称 |
货号 |
规格 |
|
UCF.METM mRNA Vaccinia Capping Enzyme GMP-grade |
10614ES84/92 |
2000/10000U |
|
UCF.METM mRNA Cap 2'-O-Methyltransferase GMP-grade |
10612ES84/92 |
2000/10000U |
|
UCF.METM T7 RNA Polymerase GMP-grade(1 KU/μl) |
10613ES92/97 |
10/50KU |
|
UCF.METM Murine RNase inhibitor GMP-grade |
10621ES10/20 |
10/20 KU |
|
UCF.METM Pyrophosphatase,Inorganic GMP-grade |
10620ES10/60 |
10/100U |
|
UCF.METM DNase I , RNase-free ,GMP-grade |
10611ES76/84 |
500/2000U |
|
Hifair® T7 High Yield RNA Synthesis Kit |
10623ES50/60 |
50/100T |
|
S-adenosylmethionine (SAM) |
10619ES02 |
0.5ml |
|
GTP Solution(100mM) |
10132ES03 |
1ml |
|
NTP Set Solution(ATP, CTP, UTP, GTP, 100 mM each) |
10133ES03 |
1 Set (4 vial) |
【1】Ebinger, J.E., Fert-Bober, J., Printsev, I. et al. Antibody responses to the BNT162b2 mRNA vaccine in individuals previously infected with SARS-CoV-2. Nat Med (2021)
【2】Nicole Doria-Rose, et al., (2021). Antibody Persistence through 6 Months after the Second Dose of mRNA-1273 Vaccine for Covid-19. The N Engl J Med, DOI: 10.1056/NEJMc2103916
【3】Li, J., Hui, A., Zhang, X. et al. Safety and immunogenicity of the SARS-CoV-2 BNT162b1 mRNA vaccine in younger and older Chinese adults: a randomized, placebo-controlled, double-blind phase 1 study. Nat Med (2021).
【4】https://wallstreetcn.com/livenews/1953200
