
编者按
人腺病毒(HAdVs)是引起人体感染的主要原因之一,在严重儿童胃肠炎住院中,10%以上由HAdVs感染导致。HAdVs会感染多种黏膜,包括肠道、肺、眼睛,在感染后,NK细胞会作出应答,那么在这一过程中,有何关键蛋白起到了作用呢?相关研究又是否可以在类器官上进行呢?
今天,我们特别关注一项于2021年9月17日发表在《科学·免疫学》的研究——KIR3DS1 directs NK cell–mediated protection against human adenovirus infections,该研究利用肠道类器官与NK细胞进行共培养,研究了人体细胞抵御HAdVs的关键蛋白。
一、研究背景
人腺病毒(HAdV)是导致人类感染的主要原因之一[1]。不同血清型的HAdV可感染不同黏膜部位,包括肠道、肺部和眼睛。然而,几乎所有血清型的HAdV都在肠道中复制,而肠道是 HAdV感染和再活化的主要部位。尤其是儿童和免疫力低下的人有可能患上严重的HAdV并发症,在严重儿童胃肠炎住院中,10%以上由HAdVs感染导致。在小儿异基因造血干细胞移植(allo-HSCT)后,HAdV再活化可能是一种威胁生命的疾病,以肠道炎症、肝炎和呼吸衰竭为特征,导致8~26%的死亡率。
目前,尚缺乏针对HAdV且无严重不良反应的有效疗法,这凸显了临床对新治疗策略的需求。而最近的研究发现,自然杀伤(NK)细胞是幼儿肠道中最早出现的细胞毒性淋巴细胞。NK细胞也是异体HSCT后最先恢复并进入黏膜组织的细胞之一。因此,NK细胞可能可以提供抵御病毒感染的重要天然保护,并可用于治疗严重的HAdV感染。
NK细胞识别HAdV感染的细胞取决于细胞表面配体的表达,尤其是人类白细胞抗原(HLA)分子。HAdV5编码的免疫调节E3/糖蛋白19K(E3/19K),可与内质网中的HLA I类分子结合并将其留在内质网中,从而阻止HLA I类分子来到细胞表面,E3/19K还能抑制主要组织相容性复合体I类链相关蛋白A和B(MICA/B)的表面呈递,进而避免NK细胞对其识别,实现免疫逃逸。然而,上述研究发现均来源于永生化的细胞系,恶性转化会改变NK细胞免疫配体的基线表达谱,从而影响免疫识别,并使感染实验的潜在结果与体内原代细胞的结果相比出现偏差。
此外,同种细胞系不能再现生理组织特有的细胞异质性。因而,基于原代人类上皮细胞的类器官技术为体外研究病毒感染提供了巨大的机会。因此,本研究利用人肠道类器官与NK细胞共培养的体系研究NK细胞识别及杀伤HAdV5的分子机制,为后续HAdV5感染的治疗方案又提供了新的见解。
二、主要研究成果
1、肠道类器官模型可用于HAdV5感染研究
本研究利用人的回肠组织进行肠道类器官的构建,作者采取了两种方法——基质胶支架法(MDM)和低吸附板悬浮法(无基质胶,SDM),然后对比这两种培养方法下生长起来的肠道类器官的标志物表达,发现这两者的表达没有显著差异(原文图1A和B)。之前的文献显示,低吸附培养24~48 h会影响肠道类器官的极化,即使得肠道类器官出现内外翻转,因此研究人员也对肠道类器官的细胞骨架和紧密连接蛋白进行了染色,结果显示,低吸附培养确实使得肠道类器官出现了内外翻转(原文图1C)。
HAdV5进入细胞的主要受体为柯萨奇病毒-腺病毒受体(CXADR),肠道类器官的染色结果显示,CXADR在顶侧和基底侧均有表达,但在基底侧表达较少(原文图1D)。为了评估肠道类器官的顶侧或基底侧暴露HAdV5是否影响感染动力学,研究人员利用HAdV5/mCherry病毒分别感染肠道类器官的基底侧(MDM)或顶侧(SDM),他们发现,两种条件下均检测到感染,但SDM下的感染情况更严重(原文图1E),因此,研究人员将SDM培养的顶侧暴露的肠道类器官作为后续的研究模型。
而此处用于可视化的HAdV5/mCherry毒株缺乏E3/19K,因此,研究人员利用流式细胞术检测了腺病毒蛋白来评估E3/19K的免疫调节作用。他们利用野生型(WT)和E3/19K敲除(19Kstop)的HAdV5分别感染了肠道类器官,发现WT和19Kstop HAdV5感染的肠道类器官在感染后的4天内,腺病毒六邻体蛋白阳性的感染细胞比例增加(原文图1F),因此他们选择感染3天为建模时长。

原文图1 HAdV5可有效感染肠道类器官
2、HAdV5感染的肠道类器官中NK细胞表面活化性受体(NKG2D)的配体表达上调
NKG2D的配体(NKG2DL)在稳态时表达量较低,但在病毒感染时会上调,从而使NK细胞能够识别被感染的细胞并进行杀伤。NKG2DL包括UL16结合蛋白(ULBP)和MICA/B,之前有研究表明它们会被E3/19K下调。
因此,本文作者评估了HAdV5感染对器官组织中NKG2DL表达的影响,结果显示,未感染的细胞中,NKG2DL基线表达非常低,此外,从HAdV5感染的肠道类器官中分选出六邻体蛋白阴性的细胞(未感染的细胞),NKG2DL的表达也没有出现大幅波动;相反,从HAdV5感染的肠道类器官中分选出六邻体蛋白阳性的细胞(已感染的细胞),NKG2DL的表达显著升高(原文图2A和B)。

原文图2 HAdV5使肠道类器官中经典HLA I类分子的表达失调,并使NKG2D配体表达上调
3、HAdV5感染调控肠道类器官中经典HLA分子的表达
HLA I类分子对抗原呈递及NK细胞的应答有着重要的作用,在WT HAdV5感染的肠道类器官中,全HLA I类分子的表达显著降低,而在19Kstop HAdV5感染的类器官中,全HLA I类分子的表达显著上调。HLA-A和HLA-B的表达变化是导致全HLA I类分子表达降低的主要原因,而HLA-C1/C2的表达变化较小,且不受19Kstop HAdV5的影响(原文图2A和B)。利用HLA-A和HLA-B特异性抗体对肠道类器官进行HLA I类分型,证实是HLA-A和HLA-B分子的表达变化大(原文图2A和C)。
4、HAdV5感染的肠道类器官中HLA-F的表达显著上调,而且与E3/19K无关
近期的研究表明,一种非经典的HLA-I类分子HLA-F被鉴定为激活NK细胞受体KIR3DS1的主要配体,可促进机体对病毒的控制。因此,研究人员对HLA-F的表达也进行了检测,他们发现,用Mock病毒感染(空白对照)的肠道类器官上皮细胞低表达HLA-F,而用HAdV5病毒感染的肠道类器官中:六邻体阴性的上皮细胞不表达HLA-F,六邻体阳性的上皮细胞显著高表达HLA-F,并且这种HLA-F的表达差异与E3/K19无关(原文图3A)。免疫荧光实验也呈现出了同一结果(原文图3B)。

原文图3 HAdV5感染使肠道类器官上皮细胞中HLA-F的表达上调
5、HAdV5诱导的HLA-F表达上调可引起KIR3DS1+ NK细胞对感染细胞的特异性杀伤
为了确定HAdV5诱导的HLA-F上调是否导致了KIR3DS1+ NK细胞的有效识别,研究人员首先评估了KIR3DS1与HAdV5感染的上皮细胞的结合情况。HAdV5感染的类器官中六邻体阳性细胞与可溶性KIR3DS1-Fc的结合显著高于六邻体阴性细胞和空白对照组,用抗HLA-F抗体阻断后,KIR3DS1-Fc结合情况显著降低(原文图4A)。
KIR3DS1+ Jurkat报告基因细胞(J3DS1+)转导了融合在CD3胞质区的KIR3DS1受体嵌合体结构,在该细胞中,HLA-F结合引起受体交联,导致活化标志物CD69上调。将J3DS1+和未转染的Jurkat细胞(J3DS1-)与未感染和WT HAdV5感染的类器官培养的上皮细胞共孵育。与未感染HAdV5的细胞相比,感染HAdV5的细胞中CD69+ J3DS1+细胞的比例显著增加(原文图4B)。
接下来,研究人员评估了原代NK细胞对HAdV5感染的上皮细胞的功能反应。将HAdV5感染的3D类器官的上皮细胞与原代人NK细胞共孵育,与来自同一供体的KIR3DS1- NK细胞相比,KIR3DS1+ NK细胞表现出更高的HAdV5诱导的CD107a(NK细胞脱颗粒的标志物)表达(原文图4C)。NK细胞介导的病毒控制是通过杀伤病毒感染的细胞来实现的。
因此,研究人员将同一供体的外周血单核细胞中的KIR3DS1+和KIR3DS1- NK细胞分选出来,并与未感染和HAdV5感染的类器官上皮细胞共培养。结果显示,KIR3DS1+ NK细胞对HAdV5感染的上皮细胞的特异性杀伤能力显著高于KIR3DS1- NK细胞,表现为LDH释放的增加(原文图4D),表明KIR3DS1+ NK细胞具有更强的杀伤能力。
研究人员还对儿童allo-HSCT的大型队列进行了比较分析,他们发现,与其他所有基因型(非KIR3DS1+/HLA-Bw4+)的供者相比,KIR3DS1+/HLA-Bw4+基因型的供体细胞的受者发生高HAdV病毒血症的风险较低(原文图4E)。
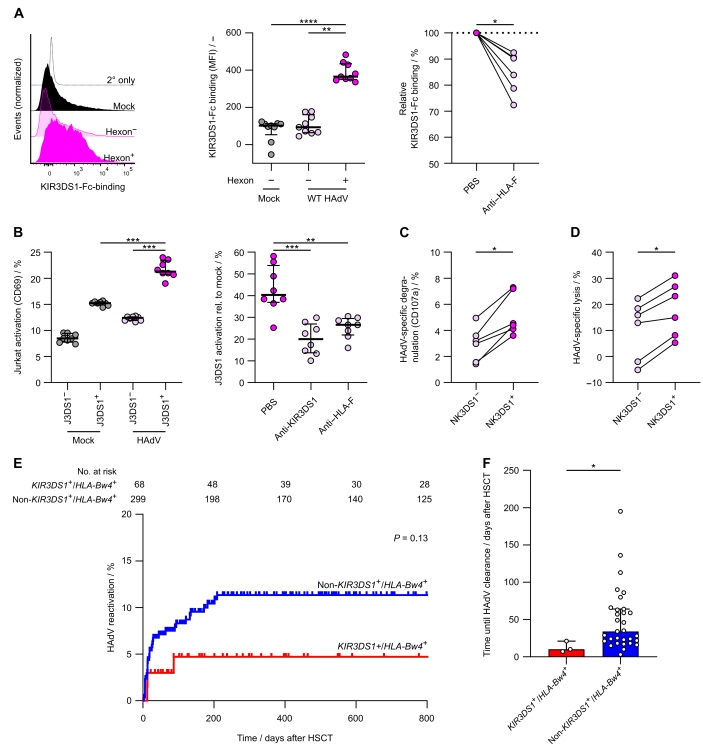
原文图4 KIR3DS1+ NK细胞具有更强的杀伤HAdV5感染的上皮细胞的能力,接受KIR3DS1+/HLA-Bw4+ allo-HSCT的患儿严重的腺病毒血症减少
三、编者点评
本文利用正常的肠道类器官与NK细胞共培养的多细胞模型,加上病毒感染,模拟了体内的病毒免疫应答情况,为后续的免疫相关研究提供了一个有力的简化模型,具有较大创新性。
本文的发现:HAdV感染细胞表达的KIR3DS1与HLA-F之间存在相互作用,可以为儿童allo-HSCT后HAdV再激活患者或先天性免疫缺陷患者提供新的免疫治疗选择,从而为儿童疾病的新型治疗方案开发提供了研发方向。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研服务CRO、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已建立肠道等多种类器官培养平台,欢迎有需要的读者垂询!
参考文献
1. J. O. Akello, R. Kamgang, M. T. Barbani, F. Suter-Riniker, S. L. Leib, A. Ramette, Epidemiology of Human Adenoviruses: A 20-year retrospective observational study in hospitalized patients in Bern, Switzerland. Clin. Epidemiol. 12, 353–366 (2020).
2. J. R. Radke, J. L. Cook, Human adenovirus infections: Update and consideration of mechanisms of viral persistence. Curr. Opin. Infect. Dis. 31, 251–256 (2018).
3. K. Kosulin, E. Geiger, A. Vécsei, W. D. Huber, M. Rauch, E. Brenner, F. Wrba, K. Hammer, A. Innerhofer, U. Pötschger, A. Lawitschka, S. Matthes-Leodolter, G. Fritsch, T. Lion, Persistence and reactivation of human adenoviruses in the gastrointestinal tract. Clin. Microbiol. Infect. 22, 381.e1–381.e8 (2016).
4. K. Kosulin, Intestinal HAdV Infection: Tissue specificity, persistence, and implications for antiviral therapy. Viruses 11, 804 (2019).
5. T. Lion, Adenovirus infections in immunocompetent and immunocompromised patients. Clin. Microbiol. Rev. 27, 441–462 (2014).
6. K. Grimwood, R. Carzino, G. L. Barnes, R. F. Bishop, Patients with enteric adenovirus gastroenteritis admitted to an Australian pediatric teaching hospital from 1981 to 1992. J. Clin. Microbiol. 33, 131–136 (1995).
7. L. Liu, Y. Qian, Y. Zhang, J. Deng, L. Jia, H. Dong, Adenoviruses associated with acute diarrhea in children in Beijing, China. PLOS ONE 9, e88791 (2014).
8. M. Mynarek, T. Ganzenmueller, A. Mueller-Heine, C. Mielke, A. Gonnermann, R. Beier, M. Sauer, B. Eiz-Vesper, U. Kohstall, K. W. Sykora, A. Heim, B. Maecker-Kolhoff, Patient, virus, and treatment-related risk factors in pediatric adenovirus infection after stem cell transplantation: Results of a routine monitoring program. Biol. Blood Marrow Transplant. 20, 250–256 (2014).
9. S. Matthes-Martin, T. Feuchtinger, P. J. Shaw, D. Engelhard, H. H. Hirsch, C. Cordonnier, P. Ljungman, European guidelines for diagnosis and treatment of adenovirus infection in leukemia and stem cell transplantation: Summary of ECIL-4 (2011). Transpl. Infect. Dis. 14, 555–563 (2012).
10. P. Sedláček, T. Petterson, M. Robin, P. Sivaprakasam, E. Vainorius, T. Brundage, A. Chandak, E. Mozaffari, G. Nichols, S. Voigt, Incidence of adenovirus infection in hematopoietic stem cell transplantation recipients: Findings from the advance study. Biol. Blood Marrow Transplant. 25, 810–818 (2019).
11. P. Ljungman, P. Ribaud, M. Eyrich, S. Matthes-Martin, H. Einsele, M. Bleakley, M. Machaczka, M. Bierings, A. Bosi, N. Gratecos, C. Cordonnier, Cidofovir for adenovirus infections after allogeneic hematopoietic stem cell transplantation: A survey by the infectious diseases working party of the european group for blood and marrow transplantation. Bone Marrow Transplant. 31, 481–486 (2003).
12. E. J. Anderson, J. A. Guzman-Cottrill, M. Kletzel, K. Thormann, C. Sullivan, X. Zheng, B. Z. Katz, High-risk adenovirus-infected pediatric allogeneic hematopoietic progenitor cell transplant recipients and preemptive cidofovir therapy. Pediatr. Transplant. 12, 219–227 (2008).
13. A. F. Sagebiel, F. Steinert, S. Lunemann, C. Körner, R. R. C. E. Schreurs, M. Altfeld, D. Perez, K. Reinshagen, M. J. Bunders, Tissue-resident Eomes+ NK cells are the major innate lymphoid cell population in human infant intestine. Nat. Commun. 10, 975 (2019).
14. J. M. Palmer, K. Rajasekaran, M. S. Thakar, S. Malarkannan, Clinical relevance of natural killer cells following hematopoietic stem cell transplantation. J. Cancer 4, 25–35 (2013).
15. J. Storek, M. A. Dawson, B. Storer, T. Stevens-Ayers, D. G. Maloney, K. A. Marr, R. P. Witherspoon, W. Bensinger, M. E. D. Flowers, P. Martin, R. Storb, F. R. Appelbaum, M. Boeckh, Immune reconstitution after allogeneic marrow transplantation compared with blood stem cell transplantation. Blood 97, 3380–3389 (2001).
16. S. S. Farag, J. B. VanDeusen, T. A. Fehniger, M. A. Caligiuri, Biology and clinical impact of human natural killer cells. Int. J. Hematol. 78, 7–17 (2003).
17. E. Vivier, E. Tomasello, M. Baratin, T. Walzer, S. Ugolini, Functions of natural killer cells. Nat. Immunol. 9, 503–510 (2008).
18. B. P. McSharry, H.-G. Burgert, D. P. Owen, R. J. Stanton, V. Prod’homme, M. Sester, K. Koebernick, V. Groh, T. Spies, S. Cox, A.-M. Little, E. C. Y. Wang, P. Tomasec, G. W. G. Wilkinson, Adenovirus E3/19K promotes evasion of NK cell recognition by intracellular sequestration of the NKG2D ligands major histocompatibility complex class i chain-related proteins A and B. J. Virol. 82, 4585–4594 (2008).
19. H.-G. Burgert, S. Kvist, An adenovirus type 2 glycoprotein blocks cell surface expression of human histocompatibility class I antigens. Cell 41, 987–997 (1985).
20. H. G. Burgert, J. L. Maryanski, S. Kvist, “E3/19K” protein of adenovirus’ type 2 inhibits lysis of cytolytic T lymphocytes by blocking cell-surface expression of histocompatibility class I antigens. Proc. Natl. Acad. Sci. U.S.A. 84, 1356–1360 (1987).
